
Читайте также:
|
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F-, SO42- , NО3-, РО43- , а также растворов щелочей выделяется кислород; б) при окислении анионов Сl-, Вr-, I- выделяются соответственно хлор, бром, иод; в) при окислении анионов органических кислот происходит процесс:
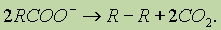
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al+ и Н+, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Си2+ и 2Сl-, которые под действием электрического тока направляются к соответствующим электродам:

На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl- и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так:
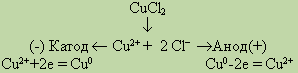
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Электролиз расплавов. Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов:

Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород,а нааноде — кислород, и электролиз сводится к электролитическому разложению воды.
Электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах.
Закон электролиза Фарадея. Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:

где т — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); п — количество отдаваемых или принимаемых электронов; I — сила тока(А); t — продолжительность процесса(с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 Кл/моль = 26,8 А×ч/моль).
Экспериментальная часть.
Опыт №1.
В пробирку с 5-6каплями раствора серной кислоты (Сэк=2) опустите маленький кусочек цинка. Напишите уравнение реакции. Какой ион выполняет функцию окислителя.
Молекулярная схема
H2SO4(р)+Zn(к) ZnSO4(р)+H2(г)
Ионная схема
H+12S+6O-24+Zn0 H02 +Zn+2S+6O-24
Окислитель восстановитель
Полуреакции окисления и восстановления
2H++2e- H02 2 восстанавливается
Окислитель 2(стехиометрический коэффициент)
Zn0-2e- Zn+2 2 окисляется
Восстановитель
Уравнение в молекулярной форме
H2SO4+Zn H2 +ZnSO4
При протекании реакции происходит выделение газа(водорода). Осадок не выпадает. Окраска раствора не происходит.
Е0=0+0.76=0.76(В)
∆rG0=-2*96500*0.76=146680(Дж/моль)
Мэк(H2SO4,восстановитель)=M(H2SO4)/2=49г/моль
Мэк(Zn,окислитель)=М(Zn)/2=32.5г/моль
Опыт 12.
В пробирку с 3-4каплями раствора нитрата калия (Сэк=2) прибавьте 2-3капли раствора серной кислоты (Сэк=2). Наблюдайте выделение бурого газа. Реакция протекает в три стадии.
Молекулярная схема
KNO2+H2SO4 HNO2+KHSO4
HNO2 HNO3+NO+H2O
NO+O2 NO2
Ионная схема
K+1N+3O-22+H+12S+6O-24 H+1N+3O-22+K+1H+1S+6O-24
H+1N+3O-22 H+1N+5O-23+N+2O-2+H2O
N+2O-2 +O02 N+4O-22
восстановитель окислитель
Из этого следует, что окислительно-восстановительными реакциями являются 2 и 3.
Полуреакции окисления-восстановления
N+2-2e- N+4 2 2 окисляется
Восстановитель 4
O02+4e- O-22 4 1 восстанавливается
Окислитель
N+3-2e- N+5 2 1 окисляется
Восстановитель 2
N+3+1e- N+2 1 2 восстанавливается
Окислитель
Уравнения в молекулярной форме
KNO2+H2SO4 HNO2+KHSO4
3HNO2 HNO3+2NO+H2O
2NO+O2 2NO2
При протекании реакции выделяется бурый газ. Раствор цвета не меняет.
Мэк(HNO2,восстановителя)=М(HNO2)/2=23г/моль
Мэк(HNO2,окислителя)=М(HNO2)/1=46г/моль
Мэк(NO,восстановителя)=М(NO)/2=15г/моль
Мэк(O2,окислитель)=М(O2)/4=8г/моль
Вывод: В данной лабораторной работе вычислил стехиометрический коэффициент, определил ЭДС, рассчитал энергию Гиббса, вычислил молярные массы эквивалентов.
Физиологические свойства синапсов
a. Одностороннее проведение
b. Синаптическая задержка
c. Декрементность (затухание) проведения при недостаточном выделении медиатора
d. Низкая лабильность – в 4-8 раз ниже лабильности нервного волокна (объясняется синаптической задержкой)
e. Проводимость через синапсы угнетается или стимулируется различными веществами
f. Утомляемость (синаптическая депрессия) – истощение медиатора.
6. Возбуждающие синапсы – оказывают возбуждающее влияние на эфферентные нейроны.
В возбуждающем синапсе в результате взаимодействия медиатора с рецептором происходит активация хемо-зависимых каналов постсинаптической мембраны. В отсутствие медиатора канал закрыт. При взаимодействии медиатора с рецептором на мембране происходит открытие ионных каналов для натрия. (см. выше)
Тормозящие синапсы – оказывают тормозное влияние на эфферентные нейроны.
В тормозных синапсах при действии медиатора происходит гиперполяризация (повышается проницаемость для К и Сl). Это называется тормозной постсинаптический потенциал (ТПСП).
При гиперполяризации снижается возбудимость и клетка тормозится (перестает отвечать на другие раздражители).
Затем медиатор разрушается, идет обратный захват пресинапсои (либо целого медиатора, либо его осколков).
7. Модуляция синаптической передачи (обеспечение надежности изменение варианта ответа)
Модулирование синаптической передачи осуществляется гуморальными факторами, изменяющими характер протекания пресинаптических и постсинаптических процессов.
Пресинаптические механизмы модуляции связаны с изменением квантового выхода медиатора, который происходит в следствии:
a. изменения кальциевой проницаемости пресинаптического нервного окончания,
b. изменения натриевой проницаемости мембраны нервного окончания,
c. изменения количества медиатора путем нарушения его синтеза или опустошения везикул с медиатором.
Постсинаптические механизмы связаны с:
a. изменением чувствительности рецепторов к медиатору
b. изменением количества рецепторов на постсинаптической мембране (действие препаратов кураре, атропина, стрихнина)
c. изменением активности ферментов, разрушающих комплекс рецептор+медиатор (действие ФОС)
Модулирование синаптической передачи является частным случаем влияния микроокружения (микросреды) или внешней среды на процесс реализации моторных, секреторных эффектов и изменений метаболизма.
Дата добавления: 2014-12-15; просмотров: 36 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими. | | | Физиология человека и животных |