
Читайте также:
|
Ацетооцтовий ефір - приклад з'єднання з відчутним вмістом енольной форми (7% для чистого речовини). Стабілізація його енольной форми обумовлена тими ж факторами, що і для b-дикетонов, але в даному випадку вони діють менш ефективно, тому зміст енола невисокий (вміст енольной форми в ацетилацетоні, наприклад, досягає 80%).
Енергія переходу між кетонної і енольной формою становить близько 8 кДж / моль. Як і у випадку оксосполук, таутомерні перехід каталізується кислотами і підставами, тому абсолютно чистий ацетооцтовий ефір вдалося розділити на енолят і кетон шляхом виморожування або перегонки в посуді зі спеціального скла [3].
Ацетооцтовий ефір схильний до утворення сіль образних з'єднань при обробці сильними підставами. Це явище називають СН-кислотністю, хоча в даному випадку термін не зовсім коректний: адже процес іонізації ацетооцтового ефіру, як і будь-якого b-дікарбонільних сполуки, можна розглядати і як відрив ОН-протона від енольной форми. Так чи інакше, незалежно від того, яка форма депротонірується, виникає один і той же резонансно-стабілізований аніон.
Ацетооцтова (β-кетомасляна кислота) є найпростішою β-кислотою. СН3СОСН2СООН — в’язка рідина, T кип. 100 °С (з розкладанням), змішується в усіх співвідношеннях з водою, розчинна в спирті, ефірі. Легко декарбоксилюється при кімнатній температурі або при незначному нагріванні, утворюючи ацетон; міститься в сечі хворих на діабет.
Виявлення кислотних властивостей ацетооцтового естеру
Ацетооцтовий естер має кислотні властивості і нейтралізує луг.


Реакції енольної форми
Для ацетооцтового ефіру характерні також перетворення, в які вступає його енольними таутомер. До них, насамперед, відносяться реакції з електрофілами. Останнє можливо завдяки тому, що зв'язок С = С в молекулі енола сполучена з донорною ОН-групою.
Так, ацетооцтовий ефір легко реагує з елементарним бромом по СН2-групі:
Реакцію можна розглядати як приєднання Br2 до поляризованої кратному зв'язку з подальшою стабілізацією за рахунок відщеплення HBr.
Ацетооцтовий ефір піддається нітрозірованія при обробці азотистої кислотою, що утворюється in situ з нітриту натрію і мінеральної або органічної кислоти. Продукт реакції являє собою монооксім a, b-дікетоефіра.
До реакцій ацетооцтового ефіру із слабкішими електрофілами можна віднести азосполучення і конденсацію з альдегідами. Однак, якщо азосполучення можна провести в нейтральній середовищі, то для другого перетворення часто доводиться застосовувати основний каталіз.
У переважній більшості випадків все реакції такого типу призводять до виникнення подвійного зв'язку атома вуглецю, розташованого між карбонільними групами, з приєдналася атомом реагенту. Це пов'язано з резонансною стабілізацією відповідних продуктів [1].
Нарешті, ацетооцтовий ефір і його похідні проявляють високу схильність до комплексоутворення з катіонами металів, таких як залізо, нікель, мідь і т.п. Це пов'язано з тим, що молекули цих сполук здатні утворювати два зв'язки з іоном - одну формально ковалентну, іншу формально координаційну. Ліганди такого типу називаються бідентантнимі (двухзубая), а комплекси на їх основі - хелатними.
Комплекси кетоефіров з металами використовуються для їх виявлення, виділення, очистки та ідентифікації, а також застосовуються в каталізі.
Реакції натрійацетоуксусного ефіру
Аніон ацетооцтового ефіру проявляє властивості сильного нуклеофіла і вельми легко взаємодіє з алкилирующими і ацилирующей реагентами.
Взаємодія ацетооцтового естеру з металічним натрієм.
Натрій активно взаємодіє з ацетооцтовим естером і виділяється газоподібний продукт (водень). Газ запалюється зі звуком, характерним для загоряння суміші водню з повітрям (гримучий газ) і горить злегка блакитим полум’ям, характерним для горіння водню. Під час реакції утворюється натрійацетооцтовий естер, який при охолодженні реакційної суміші випадає в осад.

Виявлення подвійного зв’язку в ацетооцтовому естері
Знебарвлюється бромна вода, що свідчить про ненасиченість ацетооцтового естеру.

Виявлення енольної форми ацетооцтового естеру
З’являється фіолетове забарвлення, зумовлене утворенням комплексної солі енольної форми ацетооцтового естеру з іонами Fe3+:
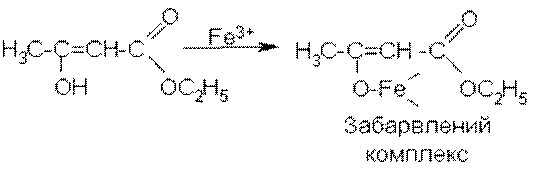
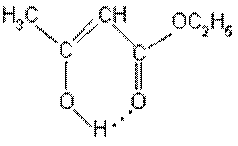
Енольна форма ацетооцтового естеру стійка за рахунок утворення внутрімолекулярного водневого зв’язку:
Доведення наявності рівноваги між таутомерними формами (кетонною і енольною) ацетооцтового естеру
Фіолетове забарвлення розчину зникає, але через декілька секунд знову з’являється. Коли фіолетове забарвлення відновиться, до реакційної суміші знову додають кілька краплин бромної води. Фіолетове забарвлення спочатку зникає, але швидко відновлюється. Явище, що спостерігається, пояснюється існуванням двох таутомерних форм ацетооцтового естеру, які завжди існують разом і перебувають у стані динамічної рівноваги:

Залежно від природи хімічного реагенту одна із цих форм буде вступати у хімічну реакцію. Це призводить до порушення динамічної рівноваги. Щоб відновити рівновагу, друга таутомерна форма буде ізомеризуватися у ту, що вступила в реакцію. Так, поява фіолетового забарвлення при додаванні до ацетооцтового естеру розчину ферму(ІІІ) хлориду свідчить про наявність в ацетооцтовому естері енольної форми (енольної гідроксильної групи). При додаванні бромної води фіолетове забарвлення розчину зникає, оскільки бром приєднується до подвійного зв’язку, і гідроксильна група втрачає енольний характер: [9]
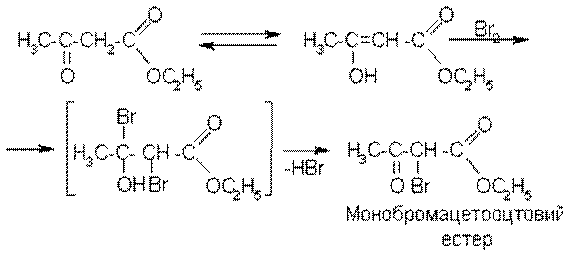
Зв’язування бромом енольної форми порушує динамічну рівновагу і тому частина кетонної форми ацетооцтового естеру, що не вступила в реакцію, щоб відновити рівновагу, ізомеризується в енольну форму. При цьому фіолетове забарвлення з’являється знову.
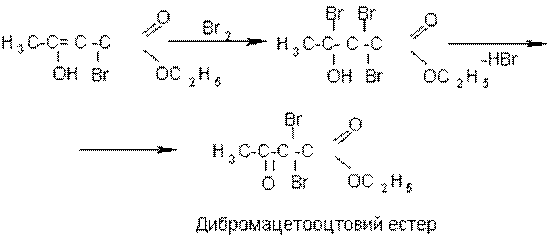
В енольну форму може ізомеризуватися також монобромацетооцтовий естер, який містить активний (рухливий) атом гідрогену:
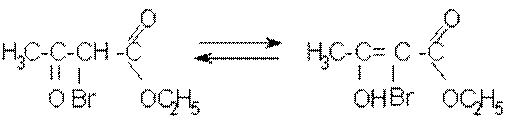
Додавання бромної води знову зумовить зникнення фіолетового забарвлення, яке через декілька секунд знову з’являється. Процес може тривати до повного заміщення активних атомів гідрогену ацетооцтового естеру на бром. При цьому утворюється дибромацетооцтовий естер, що вже не здатний до таутомерних перетворень:
Кетонне розщеплення ацетооцтового естеру.
Реакції кетонної форми
Позитивний заряд на атомі вуглецю кетонної групи більше, ніж на С-атомі складно ефірного фрагмента. Тому реакції кетонної форми ацетооцтового ефіру полягають у приєднанні, або приєднанні-отщеплении нуклеофілів по карбональній групі. Так, етілацетоацетат, як і інші кетони, реагує з ціаністим воднем і бісульфітом натрію, утворюючи відповідні аддукти.
Реакція ацетооцтового ефіру з амінами приводить до відповідних азометинів, які існують у вигляді більш стійких таутомерів - ефірів амінокротонових кислот. Як і синтез підстав Шиффа, ця реакція оборотна й добре йде при видаленні води. В іншому випадку амінокротоні ефіри з виділенням спирту перетворюються на аміди ацетооцетної кислоти.
Амінокротонові ефіри легко утворюються при досить низьких температурах, щоб їх можна було назвати продуктами кінетичного контролю. Синтез більш стабільних амідів ацетооцетної кислоти, навпаки, вимагає жорсткіших умов і незворотній, тому їх називають термодїнамичними продуктами.
Наявність двох електроноакцепторних груп є причиною того, що реакція ацетооцтового ефіру з біфункціонального нуклеофилами часто призводить до циклічних продуктам. Так, гідразину і гідроксиламін дають, відповідно, похідні піразолу і ізоксазола, а при взаємодії з сечовини утворюються піримідинів.
Дією пентахлориду фосфору ацетооцтовий ефір можна перетворити на b-хлоркротоновий ефір («хлорангидрид Енола»):
Відбувається гідроліз ацетооцтового естеру і утворюється нестійка ацетооцтова кислота, яка легко декарбоксилюється. Карбон(IV) оксид, який при цьому утворюється викликає помутніння вапняної (баритової) води. Крім карбон (IV) оксиду при декарбоксилюванні ацетооцтової кислоти утворюється також етанол і ацетон. В одержаному розчині виявляють етанол і ацетон йодоформною пробою.



Солі ацетооцтового ефіру відносяться до так званих амбідентних нуклеофіли: залежно від умов реакція ацилірования може протікати як по атому вуглецю, так і по карбонільного кисню. Атом кисню складноефірної групи практично ніколи не зачіпається, т.к. на ньому зосереджений менший негативний заряд. Співвідношення продуктів залежить від характеру розчинника: в полярних протонних розчинниках (спирт) реакція йде переважно по вуглецю, а полярних апротонних (ацетон, диметилформамід, диметилсульфоксид) збільшується вихід продуктів ацилірования по кисню.
Крім того, особливою схильністю до реакції по кисню володіють тетраалкіламмоніеві солі ацетооцтового ефіру. Це пов'язано з тим, що катіон тетраалкиламмония, на відміну від натрію, не здатний координуватися з атомом кисню і блокувати його нуклеофільні властивості. Синтез О-аціленолов ацетооцтового ефіру нерідко проводять в піридині, де ацилірующім реагентом є N-ацілпірідініевая сіль. Реакція протікає через проміжне утворення аддукта по a-положенню гетероциклу.
Дата добавления: 2014-11-24; просмотров: 453 | Поможем написать вашу работу | Нарушение авторских прав |