
Читайте также:
|
Найчастіше метод електрофорезу застосовують для аналізу й очищення білків і нуклеїнових кислот, хоча цей метод може бути використаний і для інших заряджених біологічних молекул, таких як вуглеводи, амінокислоти, пептиди, нуклеотиди тощо.
Для фракціонування білків, нуклеїнових кислот і їх фрагментів також використовують майже винятково гель-електрофорез. Найбільше широко використовуються поліакриламідні (ПААГ) гелі й гелі агарози.
Варіюючи концентрацію полімеру, можна отримувати гелі з дуже широким діапазоном розмірів пор. Крім того, можна змінювати електричні заряди макромолекул шляхом варіації рН буферного розчину, а їх конфігурацію шляхом введення в буфер денатуруючих агентів або детергентів. У якості інших «носіїв» рідкої фази широко використовують плівки з ацетату целюлози, фільтрувальний папір, тонкі шари силікагелю, целюлози, сефадексу й ін. У деяких випадках, наприклад для поділу низькомолекулярних речовин, ці системи мають свої переваги.
1.2 Види електрофорезу
Нижче наведені різні види електрофорезу з їхнім коротким описом.
Електрофорез із рухливою границею проводиться в U-образній кюветі із прямокутним поперечним перерізом. Метод розроблений для поділу білків у буфері. Основний недолік методу - наявність конвекційних потоків рідини під час проведення електрофорезу.
Зональний електрофорез у вільному середовищі виключає конвекційні потоки за рахунок обертання електрофоретичної трубки або за рахунок проведення електрофорезу в тонкому шарі рідини.
Зональний електрофорез у градієнті щільності розроблений для стабілізації білкових зон за рахунок проведення електрофорезу в градієнті щільності сахарози, гліцерину, етиленгліколю, важкої води тощо.
З ональний електрофорез у підтримуючім середовищі з капілярною структурою
полягає в тому, що для стабілізації білкових зон у середовище, де проводиться поділ, вносяться речовини, що утворюють капілярну структуру (фільтрувальний папір, плівки з ацетату целюлози, стовпчики або блоки целюлозного порошку, гранульований крохмаль, агарові, агарозні, крохмальні або поліакриламідні гелі).
Електрофорез на фільтрувальному папері проводиться в підтримуючім середовищі, у якості якої служать смужки фільтрувального паперу.
Електрофорез на ацетаті целюлози використовує у якості підтримуючого середовища смужки ацетату целюлози.
Електрофорез у колонках і блоках гранульованого підтримуючого середовища
застосовується в основному для препаративного поділу білкових сумішей. У якості підтримуючого середовища використовуються порошки зі скла або пластмаси (полівінілхлориду), гранульований крохмаль, целюлозний порошок, а також сефадекс або агароза, приготовлені у вигляді стовпчиків або блоків.
Електрофорез в агаровому й агарозному гелях використовує у якості підтримуючого середовища названі вище пористі гелі.
Електрофорез у крохмальних гелях використовує у якості підтримуючого середовища картопляний і рисовий крохмаль.
Електрофорез у поліакриламідному гелі (ПААГ) - найбільш використовуваний вид аналітичного й препаративного електрофорезу. Цей метод використовує як підтримуюче середовище співполімер акриламіду й бісакриламіду.
Ізоелектричне фокусування - один з новітніх методів поділу макромолекул. Під час ізоелектричного фокусування між анодом і катодом створюється градієнт рН. Заряджені молекули, які спочатку рівномірно розподілені в середовищі або внесені в це середовище у вигляді однієї смуги, рухаються відповідно до їхнього фактичного заряду в напрямку протилежно зарядженого електрода. Якщо ці молекули амфотерні, тобто містять групи, здатні нести різний електричний заряд, залежно від навколишнього рН, то при переміщенні в градієнті штучно сформованого рН їх сумарний заряд буде безупинно змінюватися доти, доки вони не досягнуть положення, де він стане рівним нулю. Це відбувається в тому місці градієнта рН. де значення рН буде дорівнювати ізоэлектричній точці молекули. Таким чином, молекули, що мають однакову ізоелектричну точку, сконцентруються у вузькій зоні. Якщо штучно сформований градієнт рН стабільний, то подальших змін відбуватися не буде й молекули залишаться сконцентрованими, оскільки їх дифузії перешкоджає електричне поле.
Ізотахофорез - тип електрофорезу, при якому усі заряджені макромолекули рухаються в електричному полі з однаковими (ізо) швидкостями (тахо).
1.3 Електрофорез у поліакриламідному гелі (ПААГ)
Поліакриламідний гель у вигляді підтримуючого середовища при проведенні електрофорезу використовував Раймонд і Вейнтрауб (S. Raymond and L. Weintraub) в 1959 році. Теорію методу розробили Орнштейн (Omstein L., 1964) і Дэвис (Davis В., 1964).
1.3.1 Полімеризація поліакриламідного гелю
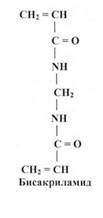
Для одержання поліакриламідного гелю використовують акриламід і який-небудь агент, що утворює поперечні зшивки - звичайно N,N'- метиленбісакриламід (скорочено -бісакриламід).

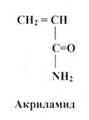
 Реакція полімеризації протікає за вільнорадикальним механізмом й вимагає наявності вільних радикалів акриламіду. У якості ініціаторів реакції полімеризації використовують речовини, що руйнуються з утворенням вільних радикалів, які потім взаємодіють із молекулами акриламіду й запускають (ініціюють) полімеризацію. Найбільше широко в якості ініціатора процесу полімеризації використовують персульфат амонію (NH4-SO4-SO4-NH4) або калію, що утворює у водному розчині за рахунок гемолітичного розриву зв'язку радикали (NH4-SO4*). Рибофлавін також може служити ініціатором полімеризації: при висвітленні його водного розчину денним світлом (445 нм) він приєднує водень і відновлюється до лейкорибофлавіну, який легко окиснюється розчиненим у воді киснем, утворюючи перекис водню. За рахунок розкладання перекису вивільняються гідроксильні радикали, що ініціюють ланцюгову реакцію полімеризації акриламіду. Оскільки реакція полімеризації акриламіду - повільний процес, то для прискорення процесу полімеризації як каталізатора звичайно використовують
Реакція полімеризації протікає за вільнорадикальним механізмом й вимагає наявності вільних радикалів акриламіду. У якості ініціаторів реакції полімеризації використовують речовини, що руйнуються з утворенням вільних радикалів, які потім взаємодіють із молекулами акриламіду й запускають (ініціюють) полімеризацію. Найбільше широко в якості ініціатора процесу полімеризації використовують персульфат амонію (NH4-SO4-SO4-NH4) або калію, що утворює у водному розчині за рахунок гемолітичного розриву зв'язку радикали (NH4-SO4*). Рибофлавін також може служити ініціатором полімеризації: при висвітленні його водного розчину денним світлом (445 нм) він приєднує водень і відновлюється до лейкорибофлавіну, який легко окиснюється розчиненим у воді киснем, утворюючи перекис водню. За рахунок розкладання перекису вивільняються гідроксильні радикали, що ініціюють ланцюгову реакцію полімеризації акриламіду. Оскільки реакція полімеризації акриламіду - повільний процес, то для прискорення процесу полімеризації як каталізатора звичайно використовують
N,N,N',N' – тетраметилетилендиамін (CH3)2-N-CH2-CH2-N-(СНз)2 (ТЕМЕД).
Можливе використання наступних пар каталізаторів і ініціаторів:
1. Персульфат амонію + ТЕМЕД
2. Персульфат амонію + ДМАПН (3-диметиламінопропіоннітрил)
3. Рибофлавін + ТЕМЕД (фотополімеризація)
4. Перекис водню + сульфат заліза + аскорбінова кислота
1.3.2 Щільність гелю (розмір пор)
Для характеристики поліакриламідного гелю необхідно вказувати процентний вміст мономерів. Стандартно використовують наступні позначення:
Т - відсоткове відношення сумарної маси обох мономерів до обсягу розчину,
С - відсоткове відношення маси бісакриламіда до загальної маси обох мономерів. (Т = акриламід + мономер, що утворює зшивки) і кількість агента, що зшиває, у відсотках від загальної кількості мономерів (С):
Т = (а + b)/m • 100%
С = b/(а + b) • 100%
а - кількість акриламіду;
b - кількість мономеру, що утворює зшивки (бісакриламіду);
Т - об’єм буферу, мл.
Т звичайно варіює в межах 3-30%, а С 1-5%. Вибір значень С и Т визначається діапазоном фракціонування білків і обмежується механічними й адсорбційними властивостями гелю. Для крупнопористих гелів необхідно збільшувати ступінь зшивки (підвищувати С до 3-5%), для дрібнопористих гелів величина С не повинна перевищувати 1-2%.
На перший погляд чим більше Т, тем дрібніше пори, але це не завжди так, оскільки ПААГ не є регулярними просторовими ґратами із твердими гніздами певного середнього розміру. При малих значеннях С він являє собою скоріше довгі нитки, що заповнюють увесь обсяг і лише в окремих точках випадково зшиті між собою. Така система не може бути внутрішньо твердою. Тому мігруючі в гелі макромолекули, очевидно, можуть розсовувати гнучкі довгі ділянки лінійних полімерів акриламіду, при цьому міграція молекул уповільнюється й відбувається своєрідне тертя їх про гель. Однак жорстких обмежень на розмір мігруючих молекул така система не накладає, і це дуже суттєво.
Чим вище концентрація заполімеризованого акриламіду, тим менший розмір пор у
гелі:
р = 1,5 d / √ с, де
р - розмір пор в ангстремах
с - об'ємна концентрація акриламіду
d - діаметр молекули акриламіду
Чим більше вміст акриламіду (а величина Т, в основному, визначається їм), тим густіше нитки полімеру, менше проміжки між ними й сильніше тертя. Збільшення вмісту «зшивки» (С) спочатку підвищує твердість гелю, тому що середня довжина вільних ділянок ниток зменшується. Тертя при цьому збільшується, а міграція біополімерів у гелі уповільнюється. Однак далі картина змінюється, експериментально показано, що зі збільшенням С вище 10% гальмуючий ефект гелю (при тих самих значеннях Т) послабляється. При С>15% гель поводиться як крупнопористий навіть при високих значеннях Т. Внутрішня структура гелю в цьому випадку набуває, очевидно, зовсім іншого характеру. Завдяки частим зшивкам енергійно вигідним і ймовірним є багаторазове зв'язування декількох паралельних ниток, що йдуть, у свого роду пучки, які також утворюють хаотично зшиту просторову сітку. Ця сітка виявляється дійсно твердою - нитки в пучках розсунути неможливо. Зате між пучками полімерних ниток утворюються досить великі порожнечі, заповнені рідкою фазою гелю, по яких можуть вільно мігрувати молекули біополімерів. Тому вміст зшивки С у гелі повинний бути в межах 2-5%.
Співвідношення між акриламідом, що й зшиває агентом визначають механічні й фізичні властивості гелю. Для гелів з концентрацією Т 5 - 15 % С рекомендується вибирати в межах 2-4 %. Для вибору С була запропонована наступна емпірична формула:
С(%) = 6,5-0,3 Т(%)
Бісакриламід, мг = 1300 / акриламід, г
Концентрація поліакриламідних гелів, які використовуються для розділення макромолекул з різними молекулярними масами
| Концентрація гелю Т, % | Концентрація бісакриламіду С, % | Межі розділення, дальтони |
| 15-20 | 0,2 | 1• 104 - 4 • 104 |
| 10-15 | 0,3 | 4• 104 - 1 • 105 |
| 5-10 | 2-3 | 1 • 105 - 3 •105 |
| 3 • 105 - 5 • 105 | ||
| 2-5 | вище 5 •105 |
1.3.3 Зв'язок між рухливістю білків і концентрацією гелю
Електрофоретична рухливість - це швидкість руху частки (зазвичай виражається в см/с) при напруженості електричного поля в 1 В/см. Ця величина має розмірність см2 • с-1 • В-1, а її знак збігається зі знаком сумарного заряду макромолекули.
Розглянемо ізольовану частку, зважену в ідеальному діелектрику. Якщо прикласти рівномірне електричне поле, то на частку буде діяти сила, рівна добутку загального заряду частки на напруженість цього поля. При накладенні електричного поля швидкість руху частки (біологічної макромолекули) досить швидко збільшується до тих пір. поки електричну силу, що діє на частку з боку електричного поля, не зрівноважить сила тертя. Після цього частка буде рухатися з постійною швидкістю.
У випадку реального електрофорезу макромолекул, процес відбувається не в діелектрику, а в розчині електроліту. При цьому навколо зарядженої частки буде існувати іонна атмосфера. Частка при цьому буде оточена дифузійною хмарою іонів, заряд яких протилежний заряду частки. На значних відстанях від частки сумарний заряд у будь-якому елементі об’єму, досить великому в порівнянні з атомними розмірами частки, дорівнює нулю. Присутність же іонної атмосфери навколо частки приводить до того, що її електрофоретична рухливість виявляється менше, чим це передбачається рівнянням. Це обумовлюється трьома причинами.
1. Потенціал на поверхні частки знижується через зниження її ефективного електростатичного заряду.
2. Електричне поле діє також і на іони, що оточують макромолекулярну частку. Оскільки знак заряду іонної хмари протилежний знаку заряду частки, хмара буде зміщатися в напрямку, протилежному руху частки, сповільнюючи тим самим її міграцію (ефект електрофоретичного тертя).
3. Має місце сповільнюваний ефект іншого роду, пов'язаний з тим, що в електричнім полі одні іони при переміщенні наближаються до частки, а інші віддаляються від неї. Внаслідок цього в іонній атмосфері відбувається безперервне заміщення іонів, що викликає порушення її сферично симетричної форми, тому що для вхідних іонів потрібний певний час, щоб знайти своє місце в полі макромолекули й прийти в рівновагу з її оточенням. У результаті подвійний електричний шар за часткою розтягується. Дія гальмуючої сили такого типу зветься релаксаційного ефекту.
Рухливість макромолекул у поліакриламідному гелі обернено пропорційна середньому розміру пор (формула Фергюсона):
Lg U = lg U0 + Kr T
Кг - коефіцієнт затримки;
U - рухливість макромолекул у гелі;
U0 - рухливість макромолекул у вільному розчині;
Т - щільність гелю (концентрація мономерів)
1.3.4 Електрофорез у ПААГ з використанням додецилсульфату натрію
Електрофоретична рухливість кожного білка залежить одночасно й від його сумарного заряду, і від молекулярної маси, і від конфігурації й від твердості упакування поліпептидному ланцюга. Внесок кожного із цих факторів невідомий і може суттєво мінятися залежно від умов форезу. Для встановлення строгої кількісної кореляції між будь-яким з перерахованих параметрів і електрофоретичною рухливістю білків треба виключити вплив усіх інших.
Одним з найбільш популярних методів є електрофорез у ПААГ з використанням додецилсульфату натрію (ДСН), який дозволяє фракціонувати білки залежно від значення тільки одного параметра - їх молекулярної маси.
Основний принцип методу - зниження впливу заряду макромолекули на її електрофоретичну рухливість. У цьому випадку повинна спостерігатися пропорційність між молекулярною масою макромолекули і її опором тертя (коефіцієнтом затримки). Для цього білки обробляють надлишком ДСН, який приблизно однаково зв'язується з переважною більшістю білків у співвідношенні 1.4 мг ДСН з 1 мг білка. Надлишок залишків сульфокислоти робить несуттєвим власний заряд білка, а сталість співвідношення детергент/білок робить практично однаковим відношення негативного заряду до маси для будь-якого білку. Крім того, при обробці білка ДСН поліпептидний ланцюжок розпрямляється й здобуває форму твердого еліпсоїда обертання, розмір великої осі обертання якого лінійно пов'язаний із числом амінокислотних залишків, а отже, з молекулярною масою білка.
Електрофоретична рухливість (u') жорсткого комплексу білок-ДСН виявляється пов'язаної з молекулярною масою білка (Мг) простим співвідношенням:
u' = А-ВlgМr,
де А и В - коефіцієнти, що залежать від пористості гелю, температури й інших умов експерименту. Величину u' зручніше представляти у відносних одиницях шляхів міграції білку й лідируючого барвника за час електрофорезу, тобто в значеннях уведеної раніше величини Rf. Для визначення коефіцієнтів А и В одночасно з фракціонуванням досліджуваної суміші необхідно провести електрофорез набору білків-«маркерів», молекулярні маси яких точно відомі. По закінченню форезу, вимірявши шлях міграції лідируючого барвника (бромфенолового синього) і кожного з маркерів, можна розрахувати значення Rf і, знаючи молекулярні маси маркерів, побудувати експериментальну залежність lgМг від Rf. Якщо пористість гелю обрана вдало, то така залежність буде лінійною. Визначивши тепер Rf для білка, що цікавить нас, з графіку можна знайти для нього величину lgМг і розрахувати Мг.
При даній пористості (концентрації) гелю описана вище лінійна залежність має місце тільки для білків, молекулярні маси яких лежать у певному інтервалі. Для орієнтування можна назвати зразкове значення концентрації акриламіду залежно від молекулярної маси білків:
Т, % 5 10 15
Мг, кДа 18-330 10-100 10-60
Найбільше широко використовуваним варіантом електрофорезу з додаванням ДСН є диск-електрофорез по Леммлі [3]. Цей метод дозволяє значно поліпшити поділ білків, що фракціонуються, за рахунок введення додаткового так званого «формуючого» («концентруючого») крупнопористого гелю, у якому білки не фракціонуються, а тільки концентруються у вигляді дуже вузьких смуг перед переходом у поділяючий гель. Система Леммлі дозволяє добре розділяти білки із Мг = 15-200 кДа. Для аналізу низькомолекулярних білків і пептидів найбільше широко використовується система запропонована Шаггером [4].
2. ПРАКТИЧНА ЧАСТИНА
Завдання практичної частини:
1. Приготування необхідних розчинів і буферів (згідно із протоколом методу):
a) Приготування розчину для заливання гелю, що концентрує
b) Приготування розчину для заливання поділяючого гелю
c) Приготування розчину персульфату амонію
d) Дегазація розчинів для заливання, що концентрує й поділяючого гелю
2. Полімеризація поліакриламідних гелів:
a) Зібрати систему для заливання гелів, відзначити маркером границі заливання поділяючого гелю
b) Додати персульфат у розчин і залити поділяючий гель (проводити дуже швидко)
c) Обережно нашарувати приблизно 100 мкл води на гель для усунення пухирців
d) Дочекатися поки гель застигне й з'явиться чітка границя між водою й гелем - вилучити нашаровану раніше воду
е) У розчин для гелю, що концентрує, додаємо персульфат та заливаємо його у трубку на поділяючий гель
g) Обережно нашарувати приблизно 100 мкл води на гель для усунення пухирців
h) Дочекатися поки гель застигне й з'явиться чітка границя між водою й гелем - вилучити нашаровану раніше воду
3. Підготовка зразків
a) Готовимо зразки для електрофорезу: змішуємо аналізовані проби з буфером для зразків у співвідношенні 1:2 і кип'ятимо 5 хв.
b) У нижню частину камери заливаємо анодний буфер
4. Нанесення зразків та складання апарату для проведення електрофорезу:
a) Збираємо систему для проведення електрофорезу (у верхню камеру вставляємо трубочки з гелем та обережно наносимо проби (по 10 мкл у кожну), заповнюємо трубочки до верху катодним буфером (через різницю в щільності буфер зі зразками не змішується з катодним буфером),
b) Якщо трубочок зі зразками менше ніж 10 шт, то вільні отвори закриваємо заглушками.
c) Заливаємо катодний буфер у верхню частину камери
5. Проведення електрофорезу
a) Повністю збираємо систему для проведення електрофорезу й підключаємо її до джерела току: спочатку форез ведеться при силі току 2 мА на кожну трубочку (тобто 20 мА на 10 трубочок), після переходу лідируючого барвника з концентруючого в поділяючий гель силу току збільшують до 40 мА (у випадку використання стабілізації по напрузі 50 В и 120 В, відповідно)
b) Виключаємо систему, після того як смуга лідируючого барвника дійде до нижньої межі гелю
6. Фіксація й фарбування гелю
a) Гель за допомогою шприцу з водою виймаємо з трубочок і поміщаємо у фіксуючий розчин
b) Потім гель обезбарвлюємо й відмиваємо від надлишкової фарби згідно із протоколом методу
7. Аналіз результатів
a) Фотографуємо гель, використовуючи систему гель-документування
b) Аналізуємо отримані результати, використовуючи спеціальні програми
2.1Стокові розчини
Зауваження:
Для всіх розчинів необхідно використовувати або дистильовану воду.
Усі розчини готовити тільки на Трис (а не ирис-Нс1); рН доводити концентрованою соляною кислотою (не доводити рН NaОН у жодному разі!!! - це приводить до збільшення іонної сили буферу, тому, що утворюється NaCl, який сильно впливає на силу току при е/ф). Стоки, що містять акриламід і бісакриламід необхідно розчиняти при постійному перемішуванні, після доведення об’єму обов'язково профільтрувати (розчинити наважку акриламіду у 50 % об’єму, на отриманому розчині готувати розчин бісакриламіду). Зберігати при +4°С не більш 3-х місяців.
2.1.1 Концентрат гелю – 15 %(14% Т, 1% С):
1. Акриламід – 13, 93 % розчин (13, 93 г розчинити у 50 мл дистильованої води)
2. Бісакриламід - 1,07% розчин (1,07 г розчинити у 13.93 % розчині акриламіду та довести дистильованою водою до 100 мл)
Розчин обов'язково профільтрувати. Зберігати при +4°С не більш 3-х місяців.
2.1.2 Буфер для концентруючого гелю (рН 6,8):
1. 0,5 М Трис-НCl (11,96 г Трис + 80 мл води + 96 мл 1 н НCl – довести до 200 мл дистильованою водою).
2. Додатки (108 г сечовини + 77,4 мг аскорбінової кислоти – довести до 200 мл 0,5 М Трис-НCl буфером)
3. 0,4% SDS (розчинити 400 мг SDS у 100 мл 0,5 М Трис-НCl буферу з додатками)
4. рН доводити перед додаванням SDS. Зберігати при +4°С.
2.1.3 Буфер для поділяючого гелю (рН 8,8):
1. 1,5 М Трис-НCl (36, г Трис + 40 мл води + 48 мл 1 н НCl – довести до 100 мл дистильованою водою).
2. Додатки (54 г сечовини + 38, 6 мг аскорбінової кислоти – довести до 100 мл 1,5 М Трис-НCl буфером)
3. 0,4% SDS (розчинити 400 мг SDS у 100 мл 1,5 М Трис-НCl буферу з додатками)
4. рН доводити перед додаванням SDS. Зберігати при +4°С.
2.1.4 Анодний буфер для електрофорезу (рН 8,6):
1. 0,025 М Трис-НCl – 0,192 М гліциновий буфер (48,8 г гліцину розчиняють у 1 000 мл дистильованої води та додають 6 г Трису, потім об’єм доводять водою до 2 000 мл).
2.1.5 Катодний буфер для електрофорезу (рН 8,6):
1. 0,025 М Трис-НCl – 0,192 М гліциновий буфер з додаванням 0,1% SDS (1 г SDS розчиняють у 1 000 мл 0,025 М Трис-НCl – 0,192 М гліцинового буферу)
2. 0,001 % розчин бромфенолового синього (0,001 г бромфенолового синього доводять до 100 мл дистильованою водою та фільтрують). Зберігають при + 4 0С.
3. 0,025 М Трис-НCl – 0,192 М гліциновий буфер з додаванням 0,1% SDS та бром феноловим синім (до буферу додають 2 мл 0,001 % розчину бромфенолового синього).
4. рН доводити перед додаванням SDS. Зберігати при +4°С.
2.1.6 Буфер для зразків:
1. Розчин А (до 100 мл концентруючого гелю додають 0,46 мл ТЕМЕДа)
2. Розчин Б (44 г сечовини довести до 100 мл дистильованою водою)
3. Уважнювач з додаванням 2 % SDS та 5 % β-меркаптоетанолу (2 мл розчину А + 8 мл розчину Б + 0,2 г SDS та 0,5 мл β-меркаптоетанолу)
4. Зберігати при -20°С не більш 6 місяців.
2.2 Заливання гелю:
2.2.1 Поділяючий гель (12,5%):
1. Розчин акриламідного гелю (6,25 мл концентрату гелю (див. 2.1.1) + 3,75 мл буферу для поділяючого гелю (див. 2.1.3) + 2,5 мл дистильованої води)
2. Розчин персульфату амонію (8 мг персульфату амонію розчинити у 2,5 мл дистильованої води)
3. Поділяючий гель (з’єднати розчини акриламідного гелю з 9 мкл ТЕМЕДу та додати для полімеризації розчин персульфату амонію)
2.2.2 Концентруючий гель (4 %):
1. Розчин акриламідного гелю (2 мл концентрату гелю (див. 2.1.1) + 2,5 мл буферу для концентруючого гелю (див. 2.1.2) + 3 мл дистильованої води)
2. Розчин персульфату амонію (7 мг персульфату амонію розчинити у 2,5 мл дистильованої води)
3. Концентруючий гель (з’єднати розчини акриламідного гелю з 8 мкл ТЕМЕДу та додати для полімеризації розчин персульфату амонію)
2.3 Підготовка зразків
Водний розчин білку змішати з буфером для зразків (див. 2.1.6) у співвідношенні 1:2та витримують 5 хвилин за температури 90-95 0С.
2.4 Розчин для фіксації й фарбування гелю
2.4.1 Розчини для фіксації
1. Суміш 5 % розчину трихлороцтової кислоти (ТХО) та 5 % розчину сульфосаліцилової кислоти (5 г ТХО та 5 г сульфосаліцилової кислоти розчинити у 100 мл води). Гель витримувати у цьому розчині на протягом 30-60 хвилин.
Або
2. 70 % розчин ізопропанолу (70 мл ізопропанолу довести до 100 мл дистильованою водою). Гель витримувати у цьому розчині на протягом 30-60 хвилин.1 – 3 годин
2.4.2 Розчини для фарбування (час фарбування – 2-3 години)
1. 1 % розчин Кумасі R-250 (10 г фарби розчиняють у 1 000 мл дистильованої води) Фарбу профільтрувати. Зберігати в щільно закритій пляшці при температурі +4 0С.
2. 10 % розчин сульфосаліцилової кислоти (100 г сульфосаліцилової кислоти доводять дистильованою водою до 1 000 мл)
3. 10 % розчин трихлороцтової кислоти (100 г ТХО доводять дистильованою водою до 1 000 мл)
4. Змішують 1 об’єм 1 % розчин Кумасі R-250 та по 8,5 об’ємів 5 % розчин сульфосаліцилової кислоти та 5 % розчин трихлороцтової кислоти.
Або
5. 40 % розчин ізопропанолу (400 мл ізопропанолу доводять до 1 000 мл дистильованою водою)
6. 20 % розчин оцтової кислоти (200 мл оцтової кислоти доводять до 1 000 мл дистильованою водою)
7. 0,04 % розчин Кумасі R-250 (0,4 г фарби розчиняють у 1 000 мл суміші 40 % розчин ізопропанолу та 20 % розчин оцтової кислоти (1:1)
2.4 Розчин для відмивання (для другого варіанту фарбування)
1. Фарбу відмивають від гелю сумішшю ізопропанол:оцтова кислота у співвідношенні 2:1
2. Фарбу відмивають від гелю сумішшю ізопропанол:етанол:оцтова кислота:вода у співвідношенні 2:1:1:6
Література:
1. Остерман Л.А. «Методи дослідження білків і нуклеїнових кислот. Електрофорез і ультрацентрифугирование», Москва, «Наука» 1981.
2. «Protein electrophoresis)), Amersham Biosciences (www.amershambiosciences.com)
3. Laemmliu.K..Cleavageofstructuralproteinsduringtheassemblyoftheheadofbacteriophaget4. Naturе1970;227:680-685.
4. Schaggerh.,vonjagowww. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kda. Anal. Biochem., 1987; 166: 368-379
5. Практикум по биохимии: Учеб. пособие / Под ред. С.Е. Северина, Г.А. Соловьевой. - Изд-во МГУ, 1989. - 509 с.
|

|
|
Дата добавления: 2015-09-11; просмотров: 52 | Поможем написать вашу работу | Нарушение авторских прав |