
|
Читайте также: |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИНЖЕНЕРНЫХ ТЕХНОЛОГИЙ
Кафедра физической и аналитической химии
Тестовые материалы
Для итогового контроля знаний
По дисциплине
Физическая и коллоидная химия 1 часть
(наименование дисциплины по ГОС)
Для бакалавров по направлению
240100 – «Химическая технология»
280700 – «Техносферная безопасность»
3 семестр
Разработчики Заведующий кафедрой
_____________ Мастюкова Т. В. ______________ Кучменко Т.А.
(подпись) (Ф.И.О.) (подпись) (Ф.И.О.)
ВОРОНЕЖ
Химическая термодинамика
1. () система обменивается с окружающей средой энергией и веществом.
2. () система обменивается с окружающей средой только энергией.
3. () система не обменивается с окружающей средой ни энергией ни веществом.
4. Изменение функций состояния во всяком круговом процессе
больше нуля
меньше нуля
равно нулю
5. Соответствие между процессом и характеризующими его параметрами состояния:
А. изотермический a. Т = const
Б. изобарный б. р = const
В. изохорный в. V = const
Г. адиабатический г. Q = const
6.Первый закон термодинамики описывается уравнениями:




7. Уравнение первого закона термодинамики для бесконечно малого изменения системы:




8. Соответствие между условиями протекания процесса и уравнением первого закона термодинамики:
А V = const а 
Б р = const б 
В Т = const в 
Г Q = const г 
9. Изменение функции состояния от способа реализации процесса (не зависит).
10. Функциями состояния в изобарном процессе являются:
F, U, G, S, Q, A
11. Функциями процесса являются: р, V, T, H, G, S, A, Q.
12. Внутренняя энергия и энтальпия связаны уравнением:




13. Изменение энтальпии и внутренней энергии для процессов в идеальном газе связаны уравнением:




14. Для реакции протекающей в стандартных условиях
3СаО(тв) + 2Al(тв) = Al2O3(тв) + 3Ca(тв)
∆Н и ∆U соотносятся:
∆Н = ∆U
∆Н > ∆U
∆Н < ∆U
∆Н ≤ ∆U
15. Для идеального газа Ср и СV связаны уравнением:




16. Стандартная теплота образования этилового спирта при
Т = 298 К – это тепловой эффект реакции:
СН3СНО(г) + Н2 = С2Н5ОН(ж) + DН1
С2Н4 + Н2О = С2Н5ОН(ж) + DН2
2С + 1/2О2 + 3Н2 = С2Н5ОН(ж) + DН3
4С + О2 + 6Н2 = 2С2Н5ОН(ж) + DН4
17. Стандартная теплота сгорания сахарозы это тепловой эффект реакции:
11/2О2 + 12С + 11Н2 = С12Н22О11, ∆Н10
С12Н22О11 + 12О2 = 12СО2 + 11Н2О, ∆Н20
С12Н22О11 + 6О2 = 12СО + 11Н2О, ∆Н30
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6, ∆Н40
18. Тепловой эффект реакции зависит от температуры (Р= const) по уравнению:




19. Вид графика зависимости теплового эффекта от температуры, выраженной уравнением:  .
.




20. Соответствие между зависимостью теплового эффекта реакции от температуры и характером изменяется теплоемкости:
А. возрастает а. ∆Ср > 0
Б. убывает б. ∆Ср < 0
В. не зависит в. ∆Ср = 0
21. Математическое выражение II закона термодинамики:


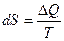

22. Энтропия правильно образованного кристалла при приближении к абсолютному нулю стремится к ().
23. Энтропия воды возрастает в ряду
 .
.
24. Энтропия вещества в жидком газообразном и твердом состоянии уменьшается в ряду:

25. Энтропия является критерием направления процессов в () системе:
26. Функция, убыль которой равна максимальнойработе обратимого процесса, называется ()
27. Соответствие между условиями и критерием самопроизвольного протекания процесса:
А. р, Т = const а. ∆G
Б. V, Т = const б. ∆F
28. Самопроизвольное смешение газов при V, T = const происходит, если:




29. Число микросостояний системы, характеризующих данное макросостояние, – это ().
30. Термодинамическая вероятность (W) и энтропия (S) связаны уравнением:




31. Химический потенциал компонента раствора при соответствующих условиях выражается:
А.  а. р, T = const
а. р, T = const
Б.  б. V, T = const
б. V, T = const
32. Реакция СаСО3(т) = СаО(т) + СО2, для которой DrH°= 178 кДж, DrS°= 160 Дж/К, при стандартных условиях…
1) протекает в прямом направлении
2) протекает в обратном направлении
3) находится в колебательном режиме
4) находится в равновесии
33. К термодинамическим функциям состояния системы не относятся…
1) работа
2) теплота
3) энтропия
4) энтальпия
34. Термохимическое уравнение синтеза аммиака имеет вид:
N2(г) + 3H2(г) = 2NH3(г), Dr H °= -92 кДж.
При получении 6,72 л аммиака выделяется ____ кДж теплоты:
1) -13,8 2) 27,6 3) 13,8 4) -27,6
35. Эндотермическими являются процессы…
1) конденсации
2) сублимации
3) плавления
36. Экзотермическими являются процессы…
1) гидролиз солей
2) окисление глюкозы
3) реакция нейтрализация
37. Уравнения реакций, для которых DrG > 0, имеют вид:
1) N2(г) + 4H2O(ж) = 2NH4NO2(т)
2) 2H2O + СО2 = СН4 + 2О2
3) NaOH + HCl = NaCl + H2O
38. Если для реакции 4NH3(г) + 3О2 = 2N2(г) + 6H2О(ж) DrH°= -1532 кДж, то при сгорании 3,4 г аммиака в 4,48 л кислорода выделяется _____ кДж теплоты.
1) 383 2) 76,6 3) 766 4) 38,3
39. К процессам, которые могут протекать самопроизвольно в изолированной системе, относятся:
1) NO2(г) + NO(г) = N2O3(г)
2) Fe2O3(т) + C(т) = 2FeO(т) + СО(г)
3) 2NH3(г) = N2(г) + 3H2(г)
40. Если изменения энтальпии при сгорании серы моноклинной S(м) и ромбической S(ромб) равны -297,21 и -296,83 кДж/моль соответственно, то изменение энтальпии при превращении 1 моль моноклинной серы в ромбическую равно ____кДж
1) +594,04 2) +0,38 3) -594,04 4) - 0,38
41. Уравнения химических реакций, которые протекают с увеличением энтропии, имеют вид…
1) СаСО3(т) = СаО(т) + СО2(г)
2) 2NН3(г) = N2(г) +3Н2(г)
3) Н2О(ж) + SO3(г) = Н2SO4(ж)
4) СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
42. Уравнение реакции, для которой энтропия системы уменьшается, имеет вид…
1) С(т) + Н2О(г) = СО(г) + Н2(г)
2) С(т) + О2(г) = СО2(г)
3) СО(г) + 3Н2(г) = СН4(г) + Н2О(г)
4) NH4NO3(т) = N2O(г) + 2Н2О(г)
43. Уравнения реакций, для которых в изобарно-изотермических условиях DrH = DrU, имеют вид:
1) СО(г) + Н2О(г) = СО2(г) + Н2(г)
2) Fe2O3(т) + 3CО(г) = 2Fe(т) + 3СО2(г)
3) Fe2O3(т) + 3C(т) = 2Fe(т) + 3СО(г)
4) СО(г) + 2Н2(г) = СН3ОН(г)
44. Для расчета изменения энтальпии реакции
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
при стандартных условиях необходимо использовать формулу …
1) DrH° = DfH°(CO2) + 2DfH°(H2O(г)) – DfH°(CH4)
2) DrH° = DfH°(CH4) – (DfH°(CO2) + 2DfH°(H2O(г))
3) DrH° = DfH°(CO2) + 2DfH°(H2O(г)) + DfH°(CH4)
4) DrH° = DfH°(CO2) – DfH°(CH4)
45. Если для реакции
2K(тв) + 2H2O(ж) = 2KOH(тв) + Н2(г)
DrН° = -382 кДж, то при взаимодействии 3,9 г калия с водой выделится ___ кДж теплоты.
1) 76,3 2) 7,63 3) 19,1 4) 191
46. Если при сгорании 5,6 л (н.у.) Н2 выделяется 60 кДж теплоты, то энтальпия образования паров воды равна ___ кДж/моль.
1) 120 2) -240 3) 240 4)-120
47. Количество теплоты (кДж), выделяемое в организме при окислении 45 г глюкозы (Df H ° = –1273 кДж/моль) до углекислого газа (Df H ° = –393 кДж/моль) и воды (Df H ° = –286 кДж/моль), равно…
1) 1400,5 2) 700,25 3) 2801 4) 466,8
48. Если для реакции
NH4NO3(т) = N2O(г) + 2H2O(г) DrH°298 = -124,2 кДж и DrG°298 = -186,7 кДж, то она является…
1) эндотермической и при стандартных условиях протекает в прямом направлении
2) экзотермической и при стандартных условиях протекает в обратном направлении
3) эндотермической и при стандартных условиях протекает в обратном направлении
4) экзотермической и при стандартных условиях протекает в прямом направлении
49. Согласно термохимическому уравнению
NH4NO3(т) = N2O(г) + 2H2O(г);  = – 124,2 кДж,
= – 124,2 кДж,
при разложении 400 г нитрата аммония ________________ кДж теплоты (зависимостью термодинамических функций от температуры пренебречь)
1) поглотится 621
2) выделится 124,2
3) поглотится 124,2
4) выделится 621
50. Если для реакции
NH4NO3(т) = N2O(г) + 2H2O(г);  = – 124,2 кДж и
= – 124,2 кДж и  = – 186,7 Дж/К,
= – 186,7 Дж/К,
то температура, при которой возможно ее протекание в прямом и обратном направлении равна ____°С (зависимостью термодинамических функций от температуры пренебречь)
1) 0,665
2) 272,3
3) 392
4) 665
51. При значении D rG = –300 кДжв изобарно–изотермических условиях реакция протекает с образованием
продуктов реакции,
исходных веществ,
состояния равновесия
Химическое равновесие
52. Константа равновесия (Кс) реакции А(г)+2B(г)=AB2 (г) при увеличении общего давление в 2 раза
уменьшится в 4 раза,
увеличится в 2 раза,
не изменится,
увеличится в 4 раза.
 53. График зависимости lnKp = f(1/T) для эндотермической реакции имеет вид:
53. График зависимости lnKp = f(1/T) для эндотермической реакции имеет вид:
54. Соответствие между химической реакцией и константой равновесия. Вещества находятся в газообразном состоянии:
А. 2A + B = 2C а. Kp = 
Б. A + 2B = 3C+D б. Kp = 
В. 2A = B + 2C в. Kp = 
55. Константа равновесия (Кс) реакции, протекающей в идеальном растворе зависит от:
природы участников
парциального давления компонентов
температуры
концентрации
56. Для реакции 2A(г)+2B(г) = 3C(г), константы равновесия Кр и Кс связаны уравнением:
Кр = КсRT,
Кр = Кс(RT)-1,
Кр = Кс,
Кр = 1/Кс.
57. Для химической реакции A + B = C + D, протекающей в идеальной газовой системе
Кр меньше Кс,
Кр равно Кс,
Кр больше Кс,
58. Соответствие между величиной константы равновесия (Ка) и характером протекания реакции:
А.  а. состояние равновесия
а. состояние равновесия
Б.  б. образование исходных веществ
б. образование исходных веществ
В.  в. образование продуктов
в. образование продуктов
59. Химическое сродство в изобарно–изотермических условиях:
DG, DF, DU, ΔH
60. Стандартное сродство и константа равновесия Ка для реакции
А + В D С + D, связаны уравнением:

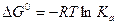


61. Теоретический выход продукта реакции в зависимости от величины химического сродства увеличивается в ряду:
 = 450 кДж;
= 450 кДж;  = 45 кДж;
= 45 кДж;  = –45 кДж;
= –45 кДж;  = –450 кДж
= –450 кДж
62. Увеличение температуры экзотермической реакции ….
сместит равновесие влево,
сместит равновесие вправо,
не изменит положения равновесия,
остановит реакцию.
63. График характеризует
 |
реакцию без теплового эффекта,
эндотермическую реакцию,
экзотермическую реакцию.
64. Для увеличения выхода продукта (_____) реакции нужно уменьшить температуру.
65. Для экзотермического процесса синтеза аммиака одновременное понижение температуры и увеличение давления … выход аммиака
1) сначала увеличивает, а затем уменьшает
2) уменьшает
3) не влияет на
4) увеличивает
66. В уравнение константы равновесия для гомогенной системы входят _____ концентрации продуктов и исходных веществ
1) равновесные
2) произвольные
3) текущие
4) исходные
67. Равновесие реакции N2(г) + 3Н2(г) Û 2NH3(г), DrH < 0 сместится в сторону продуктов реакции при …
1) увеличении объема системы
2) увеличении температуры
3) увеличении общего давления в системе
4) уменьшении парциального давления аммиака
68. Внешними воздействиями на систему
N2(г) + 3Н2(г) Û 2NH3(г), DrH < 0,
которые приведут к увеличению равновесной концентрации аммиака, являются …
1) увеличение температуры
2) увеличение давления
3) введение катализатора
4) уменьшение температуры
69. Равновесие в системе 2СО(г) + О2(г) Û 2СО2(г), DrH < 0 сместится вправо при
1) увеличении температуры
2) повышении давления
3) уменьшении температуры
4) уменьшении давления
70. Если для некоторой идеальной гомогенной равновесной системы DrG° < 0, то верными являются утверждения, что …
1) константа равновесия реакции меньше единицы
2) в равновесной смеси преобладают исходные вещества
3) в равновесной смеси преобладают продукты реакции
4) константа равновесия реакции больше единицы
71. Если для некоторой идеальной гомогенной равновесной системы
DrG° > 0, то верными являются утверждения, что …
1) константа равновесия реакции меньше единицы
2) в равновесной смеси преобладают исходные вещества
3) в равновесной смеси преобладают продукты реакции
4) константа равновесия реакции больше единицы
72. Повышение давления приводит к увеличению выхода продуктов реакции …
1) СаО(т) + СО2(г) Û СаСО3(т)
2) 2NO(г) + О2(г) Û 2NO2(г)
3) Fe3O4(т) + 4СО(г) Û 3Fe(т) + 4СО2(г)
4) СО(г) + Н2О(г) Û СО2(г) + Н2(г)
73. При повышении давления в системе
СО2(г) + Н2(г) Û СО(г) + Н2О(г), DrH > 0 …
1) увеличивается содержание продуктов
2) увеличивается содержание исходных веществ и продуктов
3) увеличивается содержание исходных веществ
4) состояние равновесия не изменяется
74. При увеличении давления в системе
2SO2(г) + О2(г) Û 2SО3(г)
увеличится выход …
1) SO2 и О2 2) О2 3) SО2 4) SО3
75. Если в колонне синтеза оксида серы (VI) при 600 °С установилось равновесие
2SO2(г) + О2(г) Û 2SО3(г), DrH < 0,
то при увеличении температуры давление в системе …
1) становится равным атмосферному
2) не изменяется
3) увеличивается
4) уменьшается
76. Уравнения реакций, в которых изменение давления не вызовет смещения равновесия, имеют вид …
1) 2SO2(г) + О2(г) = 2SО3(г)
2) Н2(г) + I2(г) = 2НI(г)
3) MgCO3(т) = MgO(т) + CO2(г)
4) Fe2O3(т) + 3CO(г) = 2Fe(т) + 3СО2(г)
77. На состояние равновесия в системе СО2(г) + Н2(г) Û СО(г) + Н2О(г), DrH > 0
не влияет изменение …
1) температуры
2) давления
3) концентрации исходных веществ
4) концентрации продуктов
78. Если при некоторой температуре константа равновесия реакции
СаСО3(т) Û СаО(т) + СО2(г)
равна 3,95×103 Па, то обратная реакция в системе будет протекать при парциальном давлении СО2 равном ____ Па
1) 1,01×104 2) 1,01×105 3) 3,00×103 4) 3,95×103
79. Константа равновесия системы определяется изменением стандартного значения ______ системы
1) энтальпии 2) энергии Гиббса 3) внутренней энергии 4) энтропии
Химическая кинетика и катализ
80. Для реакции
2NO(г) + О2(г) = 2NO2(г)
уравнение закона действующих масс имеет вид …
1) 
2) 
3) 
4) 
81. Скорость гомогенной реакции не зависит от ….
1 ) площади поверхности сосуда
2) температуры
3) времени протекания процесса
4) концентрации
82. Скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют 0,2 и 0,3 моль/дм3 соответственно, а k = 1,5×10-3 дм×моль-1×с-1, равна ______ моль/(дм3×с)
1) 9×10-5 2) 6×10-2 3) 9×10-3 4) 9×10-1
83. Если в системе СО(г) + Cl2(г) = СОСl2(г) концентрацию СО увеличили от 0,03 моль/л до 0,12 моль/л, то скорость реакции …
1) не изменилась
2) уменьшилась в 2 раза
3) возросла в 8 раз
4) возросла в 4 раза
84. Чтобы скорость реакции не изменилась при уменьшении концентрации водорода в 2 раза в системе 2Н2(г) + О2(г) = 2Н2О(г), необходимо концентрацию кислорода …
1) уменьшить в 2 раза
2) увеличить в 2 раза
3) можно не изменять
4) увеличить в 4 раза
85. Если при разбавлении раствора в 3 раза, скорость элементарной гомогенной реакции уменьшается в 9 раз, то общий порядок реакции равен … (Ответ: 2)
86. Если скорость элементарной газовой реакции при увеличении общего давления в 2 раза увеличивается в 8 раз, то общий порядок реакции равен …(Ответ: 3)
87. При повышении давления в 2 раза скорость гомогенной элементарной химической реакции
2NO + Cl2 = 2NOCl увеличится в _____ раз(-а)
1) 8 2) 2 3) 6 4) 4
88. При увеличении давления в системе в 2 раза скорость элементарной реакции
2SO2 + О2 = 2SO3
увеличится в _____ раз(-а)
1) 2 2) 6 3) 4 4) 8
89. При увеличении общего давления в 3 раза скорость элементарной газовой реакции 2NO + O2 = 2NO2 увеличится в ____ раз(-а) (Ответ: 27)
90. При увеличении давления в 4 раза скорость реакции С(т) + 2Сl2(г) = ССl4(г) возрастет в _____ раз(-а) (Ответ: 16)
91. При увеличении давления в системе
N2(г) + 3Н2(г) Û 2NH3(г)
в 2 раза скорость прямой реакции при условии ее элементарности возрастет в ______ раз(-а)
1) 32 2) 16 3) 12 4) 8
92. При уменьшении объема системы в 2 раза скорость химической реакции
2NO + О2 = 2NO2 ….
1) увеличится в 8 раз
2) уменьшится в 8 раз
3) увеличится в 2 раза
4) уменьшится в 2 раза
93. Если образец карбоната магния растворяется в серной кислоте при 25 °С за 16 секунд, а при 55 °С за 2 секунды, то температурный коэффициент скорости реакции равен…
1) 0,5 2) 2 3) 8 4) 2,67
94. Если температурный коэффициент скорости реакции карбоната магния с кислотой равен 3 и при температуре 25 °С она заканчивается за 36 мин, то при температуре 45 °С время завершения будет равно _____ мин
1) 8 2) 4 3) 3 4) 6
95. Температурный коэффициент скорости реакции равен 3. Скорость реакции, при повышении температуры от 300 °С до 340 °С увеличивается в ____ раз
1) 27 2) 12 3) 81 4) 9
96. Температурный коэффициент скорости реакции, скорость которой увеличилась в 64 раза при повышении температуры на 60 °С, равен… (Ответ: 2)
97. Если при увеличении температуры от 20 до 40 °С скорость реакции возросла в 9 раз, то значение температурного коэффициента реакции равно… (Ответ: 3)
98. Количественное влияние температуры на скорость химической реакции выражается уравнением…
1) Менделеева-Клапейрона
2) Аррениуса
3) Нернста
4) Ленгмюра
99. Если скорость реакции увеличилась в 4 раза при повышении температуры на 10 градусов, то при повышении температуры от 45 до 75 градусов скорость реакции увеличится в ____ раз(-а) (Ответ: 64)
100. Увеличение скорости реакции под действием катализатора происходит в результате …
1) уменьшения энергии активации
2) уменьшения концентрации продуктов
3) увеличения температуры
4) увеличения концентрации реагентов
Дата добавления: 2015-01-30; просмотров: 94 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Впервые в русском праве было дано определение права собственности, повторившее классическое римское определение, в следующем нормативно-правовом акте | | | Вопрос номер 6. |