
Читайте также:
|
В процессе изучения дисциплины «Химия воды и топлива» применяются следующие формы контроля:
1. проверка рабочих тетрадей с выполненной контрольной работой
2. консультирование студентов в течение семестра и перед экзаменом.
Итоговым контролем знаний являются зачет в 5 семестре.
Вопросы и задачи к контрольной работе «Химия воды и топлива»
1 Отбор проб различных объектов контроля (исходная вода, осветленная вода, обессоленная вода, конденсат турбин, конденсат сетевых подогревателей, котловая
вода, пар).
2. Качественный анализ технологической воды. Методы качественного анализа. Аналитические группы катионов и анионов. Аналитические реакции. Условия выполнения аналитических реакций. Специфические реакции. Дробный и систематический анализ.
3. Количественный анализ воды. Способы выражения концентрации (молярность, молярная концентрация эквивалента, титр, титр по определяемому веществу). Ионное произведение воды. Водородный показатель. Определение рН растворов кислот и оснований
4. Титриметрический анализ (объемный анализ). Кислотно-основное титрование. Первичный и вторичный стандартные растворы. Точка эквивалентности и конечная точка титрования. Индикаторы кислотно-основного титрования.
5. Кислотно-основное титрование. Константы кислотности и основности. Общая кислотность и общая щелочность воды. Метод прямого и метод обратного титрования.
6. Окислительно-восстановительное титрование. Перманганато-метрия. Определение общего содержания железа в воде. Определение окисляемости воды. Определение перманганатной окисляемости воды.
7. Комплексонометрический метод анализа. Жесткость воды. Общая жесткость, кальциевая и магниевая жесткость. Устранение жесткости воды методом осаждения. Умягчение воды методом катионного обмена.
8. Химические методы анализа отложений с поверхности нагрева котлов.
Анализ отложений из проточной части турбин (отбор пробы, разложение материала пробы, определение содержания крем-некислоты, определение массовой доли железа, меди и натрия/
9. Осадительное титрование. Стандартный раствор. Индикаторы. Метод Мора и метод Фольгарда. Определение хлоридов в воде.
10. Технический анализ жидкого и твердого топлива на тепловых электрических станциях.
11. На титрование 0,2648 г Na2C2O4 в кислой среде пошло 20,8 мл раствора KMnO4. Вычислить нормальность раствора KMnO4.
12.Навеску H2C2O4×2H2O массой 0,6000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование аликвоты 20,00 мл полученного раствора израсходовано 18,34 мл NaOH. Определить молярную концентрацию раствора NaOH, его титр и условный титр этого раствора по H2C2O4
13. Вычислите временную жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2.
14.. Определите жесткость воды, если на титрование 100 мл воды израсходовано 8,5 мл раствора трилона Б с молярной концентрацией эквивалента 0,05 моль/л
15 Составьте уравнение окислительно-восстановительной реакции взаимодействия перманганата калия со щавелевой кислотой в кислой среде.
16. Составьте уравнение окислительно-восстановительной реакции взаимодействия бихромата калия со щавелевой кислотой в кислой среде.
17. Рассчитайте массу навески NaCl для приготовления 250 мл раствора при условии, что на титрование 15,00 мл этого раствора затратили 12,50 мл 0,1000 М раствора AgNO3
18.К 10 мл 0,03М раствора Ba(NO3)2 прилили 10 мл 0,2 М раствора Na2CO3. Сколько мг Ba2+ могло остаться в растворе после достижения равновесия? 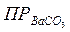 =5,1·10-9.
=5,1·10-9.
19.Определить молярную концентрацию, титр T(ЭДТА) и титр по определяемому веществу
T(ЭДТА/CaO) рабочего раствора ЭДТА (трилона Б), если на титрование навески металлического цинка массой 0,0131 г после ее растворения в соляной кислоте затратили 18,46 мл рабочего раствора.
20. Рассчитайте молярную концентрацию эквивалента раствора гидроксида натрия, если на титрование 10,00 см3 его израсходовано 12,50 см3 раствора щавелевой кислоты, Т(Н2С2О4) = 0,005230 г/см3.
21 Чему равна масса гидроксида натрия в растворе, если на его титрование израсходовано 20,00 см3 хлороводородной кислоты с ТHCl / KOH =0,003646 г/см3?
22.В мерной колбе вместимостью 100 см3 растворили оксид цинка. К 10,00 см3 полученного раствора добавили 50,00 см3 раствора серной кислоты, Т(Н2SO4) = 0,004904 г/см3. На обратное титрование израсходовано 9,25 см3 гидроксида натрия, Т(NaOH)=0,004404 г/см3. Рассчитайте массу навески оксида цинка.
23.Навеску карбоната натрия массой 0,3763 г обработали 25,00 см3 хлороводородной кислоты, С(НСl)=0,4000 моль/дм3, избыток кислоты после удаления диоксида углерода оттитровали 25,00 см3 раствора гидроксида натрия, (К=1,3000 к С(NaOH)=0,1000 моль/дм3). Вычислите массовую долю примесей в образце.
24. Рассчитайте титр сульфата цинка, если на титрование 15,00 см3 этого раствора израсходовано 14,02 см3 раствора трилона Б (ЭДТА),  = 0,0500 моль/дм3.
= 0,0500 моль/дм3.
25. Рассчитайте молярную концентрацию эквивалента раствора дихромата калия, если на титрование 20,00 см3 раствора K2Cr2O7 израсходовано 15,25 см3 раствора сульфата железа, 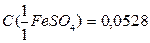
 моль/дм3.
моль/дм3.
26.Чему равен объем тиоцианата аммония, израсходованный на титрование 25,00 см3 нитрата серебра, 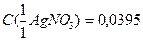 моль/дм3, если
моль/дм3, если 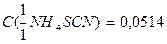 моль/дм3?
моль/дм3?
27.На титрование 25,00 см3 раствора гидроксида натрия израсходовано 27,00 см3 хлороводородной кислоты, К=0,9235 к 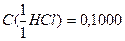 моль/дм3. Сколько граммов гидроксида натрия содержится в 1 дм3 раствора?
моль/дм3. Сколько граммов гидроксида натрия содержится в 1 дм3 раствора?
28.Какой объем раствора нитрата серебра будет затрачен на титрование 10,00 см3 раствора хлорида натрия, Т(NaCl)=0,005814 г/см3, если  моль/дм3
моль/дм3
29.Рассчитайте массу гидроксида бария, если после растворения пробы в мерной колбе вместимостью 250,00 см3 на титрование 15,00 см3 полученного раствора израсходовано 17,40 см3 раствора хлороводородной кислоты  моль/дм3.
моль/дм3.
30.Навеску технического нитрита натрия, равную 4,0250 г, растворили в мерной колбе вместимостью 250,00 см3. На титрование 20,00 см3 этого раствора затрачено 25,00 см3 раствора перманганата калия, Т(KMnO4)=0,001520 г/см3. Вычислите массовую долю нитрита натрия в образце.
| Номер варианта | N задачи | ||
Рекомендуемая литература
а) основная литература:
1.Общая химия: учебник / Коровин Николай Васильевич. – 11-е изд., стер., - М. Высшая.школа., 2009. – 557 с.
2.. Аналитическая химия. Аналитика. Кн.1.Общие теоретические основы. Качественный анализ., учебник /Харитонов Юрий Яковлевич. – 3-е изд., стер – М.Высш.шк.,2005 -615 с.
3. Аналитическая химия. Аналитика. Кн.2.. Количественный анализ. Физико – химические, учебник /Харитонов Юрий Яковлевич. – 3-е изд., стер – М.Высш.шк.,2005 -615 с.
4. Аналитическая химия: качественный анализ: метод. указания / Бурнашова Наталья Николаевна Чита: ЧитГУ, 2009.— 60с.
5. Лабораторные работы по анализу воды и водоподготовке: Методические указания. Определение основных химических показателей качества воды. ч.1. / Сергеева Цибикма Бадмаевна – Чита, 1996. – 35 с.
6. Аналитическая химия и физико-химические методы анализа: учебник. В 2 т. Т. 1 /Глубоков Юрий Михайлович, Головачёва Вера Анатольевна
под ред. А.А. Ищенко.— М.: Академия, 2010.— 352с.
б) дополнительная литература:
1. Аналитическая химия: учеб. пособие для вузов. В 2 кн. Кн. / Пилипенко Анатолий Терентьевич, Пятницкий Игорь Владимирович М.: Химия, 1990.— 846с.
2. Аналитическая химия: учебник для вузов. В 2 ч. Ч. 1: Гравиметрический и титриметрический методы анализа / Васильев Владимир Павлович М.: Высш. шк., 1989.— 320с.
Программу составила
доцент кафедры химии Н.Н.Бурнашова
Дата добавления: 2015-02-16; просмотров: 39 | Поможем написать вашу работу | Нарушение авторских прав |