
Читайте также:
|
В последующие годы довольно широкое распространение получил метод измельчения веществ с помощью ультразвука. Механизм действия ультразвука очень сложен и в настоящее время еще сравнительно мало изучен. Можно лишь предполагать, что диспергирование взвешенных в жидкости веществ происходит под действием быстро сменяющихся сжатий и расширений системы, в результате чего появляются разрывающие силы, ведущие к раздроблению вещества.
Метод химического диспергирования
Наиболее распространен метод пептизации. Это процесс перехода из геля в золь под влиянием диспергирующих веществ – пептизаторов. Сущность пептизации заключается в том, что к свежее приготовленному рыхлому осадку диспергируемого вещества прибавляют небольшое количество пептизатора (чаще всего электролита), который уменьшает взаимодействие между частицами осадка и облегчает их переход в состояние золя. Пептизаторами служат различные электролиты, которые способствуют дезагрегации аморфных осадков. В качестве примера можно назвать получение золя гидроксида Fe(OH)3 при действии на её осадок небольшим количеством соли FeCL3, выполняющей роль пептизатора. Практически все рыхлые свежеприготовленные осадки гидроксидов металлов, например AL(OH)3, Zn(OH)2, подвергаются пептизации.
К химическим методам диспергирования относится и так называемый метод самопроизвольного диспергирования. Он заключается в получении коллоидных растворов веществ путем растворения их в соответствующих растворителях. Так, путем растворения в воде можно получить коллоидные растворы крахмала, желатина, агар-агара. Самопроизвольное диспергирование совершается без внешних механических воздействий. Этот метод широко применяется для получения растворов высокомолекулярных веществ из твердых полимеров.
Образование коллоидов в природе. В природе активно протекают процессы диспергирования. Приливно-отливные явления прибоя, резкие колебания температур, ветер и другие явления природы развивают колоссальные силы, которые дробят горные породы вплоть до частиц коллоидных размеров. Постоянное действие ледников и рек также приводит к интенсивным процессам измельчения слагающих пород.
Мощным фактором механического диспергирования твердых горных пород является расширение воды при её замерзании. Проникая глубоко в трещины породы и замерзая там, вода вызывает дробление породы на частицы различного (вплоть до коллоидного) размера.
Громадные массы осадочных пород, глины, леса, которые мы встречаем в природе – все это результат диспергирования твердых осадочных пород, которое происходит не только под влиянием механических факторов, но и под влиянием химического воздействия (выветривание под действием углекислоты и воды), а также под влиянием биологических факторов. Животные, как и растения, разрыхляют горные породы и своими выделениями способствуют их изменению. Таким образом, в результате всех перечисленных выше способов горные породы, подвергаясь глубоким физическим и химическим изменениям, могут образовать сложные коллоидные системы.
2.2 Конденсационные методы
В основе большинства конденсационных методов получения коллоидных растворов лежат различные химические реакции: окисления, восстановления, реакции обменного разложения, гидролиза и др. В результате всех этих реакций молекулярные или ионные растворы переходят в коллоидные путем перевода растворенных веществ в нерастворимое состояние. В основе методов конденсации, помимо химических процессов, могут лежать и процессы физические, главным образом явления конденсации паров.
Метод окисления
Он основан на реакциях окисления, в результате которых одно из веществ может быть получено в коллоидном состоянии. Так при окислении сероводорода кислородом воздуха или диоксидом серы можно получить золь серы:
2 H2S + O2 = 2H2O + 2S
2H2S + SO2 = 2H2O + 3S
Эти реакции, как показали исследования, протекают гораздо сложнее, так как наряду с коллоидной серой образуется ряд тионовых кислот.
Метод восстановления
Наиболее распространенные химические методы получения коллоидных растворов различных металлов основаны на реакциях восстановления. Ионы, восстанавливаясь, т.е. присоединяя электроны и превращаясь в нейтральные атомы, концентрируются затем в коллоидные частицы. В качестве примера рассмотрим реакцию получения золя золота путем восстановления перекисью водорода или формалином:
2HAuCl4 + 3H2O2 → 2Au + 8HCL + 3O2
2HAuCL4 + 3HCHO + 11KOH→ 2Au + 3HCOOK + 8KCL + 8H2O
Реакцией восстановления были получены в коллоидном состоянии многие металлы Au, Ag, Pt, Rd, Ph, Os, Hg и многие другие.
Метод обменного разложения
Сущность его разложения заключается в том, что при взаимодействии двух веществ в результате реакции обменного разложения образуется новое труднорастворимое вещество, которое при наличии определенных условий способно находиться в коллоидном состоянии. В качестве примера можно назвать реакцию получения золя сульфата бария:
BaCL2 + K2SO4 → BaSO4 + 2KCL
или золя хлорида серебра
AgNO3 + KCL → AgCL + KNO3
Метод гидролиза
Этим методом широко пользуются при получении золей различных металлов из их солей, если в результате реакции гидролиза образуется труднорастворимый гидроксид. Так, например, труднорастворимый гидроксид железа образуется при гидролизе хлорида железа по уравнениям реакций:
FeCL3 + 3H2O → Fe(OH)3 + 3HCL
Fe(OH)3 + HCL → FeOCL + 2H2O
Образующаяся в результате этих реакций соль железа FeOCL диссоциирует частично на ионы:
FeOCL ↔ FeO+ + CL-
Эти ионы и обеспечивают ионогенный слой вокруг частиц Fe(OH)3, благодаря чему они удерживаются во взвешенном состоянии.
2.3 Замена растворителя
Сущность метода заключается в том, что при замене растворителя вещество, ранее находившееся в растворенном состоянии, выделяется из раствора в виде высокодисперсной фазы, нерастворимой в данном растворителе. Так, если спиртовой раствор канифоли (который представляет собой истинный раствор) небольшими порциями прибавлять в воду, образуется коллоидный раствор канифоли в воде. В данном случае спирт хорошо смешивается с водой, а канифоль очень мало в ней растворяется и поэтому выделяется в виде высокодисперсной фазы. Кроме канифоли, этим методом можно приготовлять золи серы, фосфора, мастики и т.п. также путем вливания их спиртовых растворов в воду.
2.4 Электрический метод
Этот метод, предложенный Бредигом еще в 1898г., используется преимущественно для приготовления коллоидных растворов благородных металлов. Сущность его заключается в получении электрической дуги между находящимися в воде электродами, состоящими из золота или платины, серебра, т.е. из металла, золь которого хотят получить. В дуге под воздействием высокой температуры металл электродов испаряется, а затем пары его конденсируются в частицы коллоидных размеров, образуя соответствующий золь. Весь процесс происходит при охлаждении.
Вопрос 3. Методы очистки дисперсных систем
Гидрофобные золи при их образовании почти всегда «загрязняются» различными примесями, чаще всего электролитами. Особенно загрязняются золи, в которых в избытке введен стабилизатор. Чаще в системе присутствует исходный электролит. Для получения коллоидных растворов с наибольшей устойчивостью необходимо удалять из них примеси. Рассмотрим различные методы очистки золей.
3.1 Диализ
Диализ – это процесс освобождения коллоидных растворов от примесей, способных проникать через полупроницаемые мембраны. Этот метод очистки, предложенный еще Грэмом, является наиболее простым и доступным. Процесс очистки основан на способности примесных ионов и молекул малых размеров свободно проникать через полупроницаемые мембраны, тогда как крупные коллоидные частицы такой способностью не обладают.
Полупроницаемыми являются различные растительные, животные и искусственные мембраны; их можно приготовить из пергамента, бычьего, свиного и рыбьего пузыря; из коллодия, целлофана и т.д. Приборы, в которых проводится диализ, называют диализаторами. На рис 20 изображен простейший диализатор Грэма.
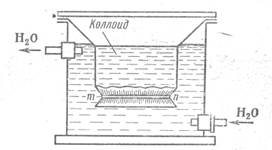
Рис 2 Схема простейшего диализатора
тп — полупроницаемая перепонка (мембрана)
В нем очищаемый золь контактирует с проточной дистиллированной водой через полупроницаемую мембрану. Чем больше разность концентраций по обе стороны мембраны, тем эффективнее идет диализ. Вот почему очистка золя ускоряется, если во внешней камере диализатора вода проточная или часто сменяется. Однако даже при этих условиях диализ идет очень медленно, длится иногда недели и даже месяцы и требует огромного количества растворителя. Для ускорения процесса диализа было предложено использовать электрический ток.
3.2 Электродиализ
Этот метод представляет собой ускоренный процесс диализа с применением электрического тока. В электродиализаторах различных конструкций имеется три камеры (рис.21) с внутренними стенками из полупроницаемых мембран. В среднюю камеру наливают коллоидный раствор, подлежащий очистке, а во внешние камеры растворитель – проточную воду. Во внешних камерах находятся электроды, на которые подается напряжение постоянного тока. При падении потенциала 20-50 в/см и более образуется направленное движение ионов к соответствующим электродам. Поскольку ионы свободно проходят через полупроницаемую перегородку, а коллоидно-дисперсные частицы не проходят, коллоидный раствор постепенно очищается от электролитов.

Рис 3 Электродиализатор Паули; 1 – коллоидный раствор; 2 – электроды
Продолжительность электролиза в отличие от простого диализа измеряется не днями, а лишь часами и минутами, причем затрата растворителя сведена до минимума. В настоящее время широкое применение метод электродиализа получил в биохимии и медицине, а также в народном хозяйстве.
3.3 Компенсационный диализ или вивидиализ
Для исследования биологических жидкостей Михаэлисом и Рона был предложен метод, позволяющий определять концентрацию тех или иных низкомолекулярных веществ, находящихся в свободном состоянии в коллоидных растворах.
Сущность компенсационного диализа заключается в том, что жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества. Так, например, сахар в сыворотке крови, не связанный с белками, определяется путем диализа сыворотки против изотонического раствора, к которому прибавляют различные количества сахара. Концентрация сахара в солевом растворе при диализе не меняется лишь в том случае, если оно равно концентрации свободного сахара в сыворотке. Этот метод позволяет судить об истинных концентрациях веществ в исследуемых коллоидных растворах. Таким путем, например, было выявлено наличие глюкозы и мочевины в крови в свободном состоянии.
Примерно на том же принципе основано прижизненное определение низкомолекулярных составных частей крови методом вивидиализа (вивидиффузия по Абелю). В концы перерезанного кровеносного сосуда вставляют стеклянные канюли, разветвленные части которой соединяются между собой трубочками из коллодия и вся система погружается в сосуд, заполняемый физиологическим раствором NaCL или водой. Было установлено, что аммиакаты в крови, так же как и глюкоза, могут находиться в свободном состоянии.
На принципе компенсационного вивидиализа был сконструирован аппарат, получивший название «искусственной почки», при помощи которого можно освобождать кровь от продуктов обмена веществ и, следовательно, временно замещать функцию больной почки. Показаниями к применению «искусственной почки» является острая почечная недостаточность, например, при отравлении сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах, токсикозе беременности и т.п.
3.4 Ультрафильтрация
Ультрафильтрацией называют фильтрование коллоидного раствора через полупроницаемые мембраны, которые укрепляются в специальных ультрафильтрах на твердой пористой подкладке.

|
Поскольку через поры обычной фильтровальной бумаги (от 1,5 до 5 мк) коллоидно-дисперсные частицы проходят легко, при ультрафильтрации пользуются специальными фильтрами, например целлофаном или фильтровальной бумагой, пропитанной коллодием. При ультрафильтрации дисперсная фаза остается на фильтре. Обычно процесс ультрафильтрации проводят под разрежением или под повышенным давлением. На рис.4 и 5 показаны установки для обоих способов ультрафильтрации.
Рис 4 Ультрафильтрация под вакуумом

|
Рис 5 Ультрафильтрация под давлением
Применяя для ультрафильтров мембраны с определенной степенью пористости, можно в известной мере произвести разделение коллоидных частиц и одновременно приближенно определить их размеры. Этим методом впервые были определены размеры целого ряда вирусов и бактериофагов.
В настоящее время методы ультрафильтрации иногда применяют в сочетании с электродиализом. Этот комбинированный метод получил название метода электроультрафильтрации. В таблице 4 дано сопоставление относительных скоростей очистки по различным методам при сравнимых условиях.
Таблица 4
Относительные скорости очистки растворов
| Метод | Удельное вещество | |
| NaCL | сахар | |
| Диализ Электродиализ Ультрафильтрация электроультрафильтрация | 0,3 |
Как видим, метод электроультрафильтрации по скорости превосходит метод электродиализа. Идея этого метода впервые была высказана в 1913г. А.В.Думанским, который применил центрифугу для осаждения коллоидных частиц. За последние годы этот метод получил исключительно широкое применение в коллоидной химии. В ультрацентрифуге оседают не только коллоидные частицы гидрофобных коллоидов, но и молекулы белков и высокомолекулярных соединений. Данный метод используют для вычисления молекулярного веса высокомолекулярных соединений, для определения среднего радиуса коллоидных частиц.
Вопрос 4. Понятие об аэрозолях, суспензиях и эмульсиях. Особенности получения и очистки.
Аэрозоли. Аэрозолями называют свободно-дисперсные системы с газообразной дисперсной средой и дисперсной фазой, состоящей из твердых или жидких частиц. Аэрозоли образуются при взрывах, дроблении и распылении веществ, а также в процессах конденсации при охлаждении пересыщенных паров воды и органических жидкостей. Аэрозоли можно получить и с помощью химических реакций, протекающих в газовой фазе.
По агрегатному состоянию частиц аэрозоли классифицируют на туманы (ж/г) – дисперсная система состоит из капелек жидкости, дымы (т/г) – аэрозоли с твердыми частицами конденсационного происхождения, пыли (т/г) – твердые частицы, образованные путем диспергирования. Возможны системы смешанного типа, когда на твердых частицах конденсируется влага. Так возникает «смог» – туман, образовавшийся на частицах дыма.
Наиболее высокодисперсными аэрозолями являются дымы, размеры твердых частиц которых находятся в пределах 10–9 – 10–5 м; частицы пыли имеют размеры свыше 10-5 м, размеры капелек туманов от 10–7 до 10–5 м.
Особенности аэрозолей заключается в том, что из-за низкой вязкости воздуха седиментация и диффузия частиц аэрозоля протекает очень быстро. Кроме того туманы и дымы очень легко переносятся ветром, что используют для создания дымовых завес, окуривания и опрыскивания сельскохозяйственных культур. Электрические свойства аэрозолей очень сильно отличаются от электрических свойств систем с жидкой средой, что объясняется резким различием плотностей и диэлектрических свойств газов и жидкостей. В газовой среде отсутствуют электролитическая диссоциация и ДЭС. Однако частицы в аэрозолях имеют электрические заряды, которые возникают при случайных столкновениях частиц друг с другом или с какой-нибудь поверхностью. Возможна также адсорбция ионов, образующихся при ионизации газов под действием космических, ультрафиолетовых и радиоактивных излучений. Для аэрозолей характерна крайняя агрегативная неустойчивость. Их длительное существование связано с высокой дисперсностью и малой концентрацией. Это значит, что устойчивость аэрозолей является лишь кинетической, термодинамические факторы устойчивости отсутствуют.
Как и любые дисперсионные системы, аэрозоли образуются двумя методами – конденсационным и диспергационным. К конденсационному методу относятся возникновение тумана при охлаждении насыщенного пара.
При диспергационных методах получения аэрозолей твердые или жидкие тела размельчают обычно механическим путем, а затем твердые частицы или жидкие капельки распределяются в газе. Например, пневматическое распыление жидкостей осуществляется с помощью аэрозольных баллончиков при получении парфюмерно-косметических аэрозолей, аэрозолей инсектицидов, эмалей.
Для аэрозолей характерны специфические процессы, связанные с их кинетическими свойствами: термофорез, фотофорез и термопреципитация. Явление термофореза заключается в движении частиц в направлении снижения температуры. Это объясняется тем, что более нагретую сторону частицы молекулы газа бомбардируют с большей скоростью, чем менее нагретую. Фотофорез заключается в передвижении частиц при одностороннем их освещении. Термофорез и фотофорез имеют большое значение в движении атмосферных аэрозолей, например при образовании облаков.
Термопреципитация представляет собой осаждение частиц аэрозоля на холодных поверхностях за счет потери частицами кинетической энергии. Этим объясняется осаждение пыли на стенах и потолке около обогревательных приборов.
Роль аэрозолей в природе, промышленности и быту чрезвычайно велика. Например, влияние облаков и туманов на климат, перенос ветром семян и пыльцы растений, пневматические способы окраски и покрытие поверхностей распыленными металлами, применение распыленного топлива, внесение удобрений.
Аэрозоли нашли широкое применение в медицине и фармации. Стерильные аэрозоли в специальных упаковках типа баллонов применяются для стерилизации операционного поля, ран, ожогов; ингаляционные аэрозоли, содержащие антибиотики и другие лекарственные вещества, применяют для лечения дыхательных путей; аэрозоли локального применения используют вместо перевязочных средств; аэрозоли в виде клея применяют в хирургической практике для склеивания ран, кожи, бронхов, сосудов и т.д.
Суспензии. Суспензии – очень распространенные микрогетерогенные системы с жидкой средой твердой и твердой дисперсной фазой с размерами частиц выше, чем в коллоидных системах, т.н. в диапазоне 10–6 – 10–4 м. Наиболее грубодисперсные системы называют взвесями. К ним относятся глинистые, цементные и известковые «растворы», масляные краски.
Отличаясь от лиофобных коллоидов в основном только более низкой степенью дисперсности, суспензии, в принципе, могут быть получены как конденсационными, так и диспергационными методами. Однако на практике их получают путем диспергирования нерастворимых твердых веществ в жидкой среде или взмучиванием в этой среде предварительно полученного порошка.
Благодаря низкой степени дисперсности в суспензиях слабо проявляются или отсутствует такое молекулярно-кинетическое свойство, как броуновское движение, а значит и диффузия. Осмотическое давление, весьма слабо выраженное в лиофобных коллоидах, в суспензиях практически не обнаруживается, так как частичная концентрация в них еще меньше, чем в лоифобных коллоидах. Вязкость разбавленных суспензий мало отличается от вязкости дисперсионной среды. Высококонцентрированные суспензии (пасты) имеют свойства структурированных систем и характеризуются высокой вязкостью.
Суспензии не проявляют светорассеяния, и к ним неприменим закон Релея, так как размер частиц в суспензиях исключает возможность дифракции.
Вследствие низкой степени дисперсности суспензии являются кинетически не устойчивыми системами (они легко седиментируются), а для достижения агрегативной устойчивости необходимо выполнение по крайней мере одного из двух условий: 1) смачиваемость поверхности частиц дисперсной фазы дисперсной средой; 2) наличие стабилизатора. Добавляемый стабилизатор вводят в виде поверхностно-активных веществ, либо в виде высокомолекулярного соединения. Если стабилизатор отсутствует, но частицы суспензии хорошо смачиваются дисперсионной средой, то на их поверхности образуется сольватная оболочка, обладающая упругими свойствами и препятствующая соединению частиц в крупные агрегаты.
Эмульсии. Эмульсии – система, состоящая из двух жидких фаз, одна из которых диспергирована в виде капелек в другой. Жидкость, раздробленная на капельки, называется дисперсной фазой, а жидкость, заполняющая объем между капельками,- дисперсионной средой. Для существования устойчивой эмульсии необходимо, чтобы жидкости, образующие эмульсию, была практически взаимно нерастворимы или обладали достаточно малой растворимостью. Размер частиц дисперсной фазы эмульсий колеблется в пределах от 10–7 до 10–5м, и поэтому их можно отнести к микрогетерогенным системам.
Характерной чертой эмульсий является то, что в зависимости от условий возникновения любая из двух жидкостей, образующих дисперсионную систему, может оказаться как дисперсной фазой, так и дисперсионной средой. Наиболее частый случай – эмульсия воды (В) и нерастворимой в ней органической жидкости (например масло, бензол, хлороформ), которую условно называют маслом (М). Возможны два типа таких эмульсий: эмульсии в которых дисперсионной средой является масло, и эмульсии с водой дисперсной фазой. Первый тип эмульсий называют эмульсией масла в воде (сокращенно М/В) или эмульсиями первого рода (прямые). Второй тип – эмульсии воды в масле (В/М) или эмульсии второго рода (обратные).
Эмульсии получают методом механического диспергирования, хотя, в принципе, возможно использование и методов конденсации. Для диспергирования qприменяют различные мешалки, смесители, гомогенизаторы, коллоидные мельницы. Высокодисперсные эмульсии часто получают способом ультразвукового диспергирования.
В зависимости от концентрации дисперсной фазы различают эмульсии разбавленные, концентрированные и высококонцентрированные. К разбавленным эмульсиям относят эмульсии, содержащие не больше 0,1% (об.) дисперсной фазы. Концентрированными считают эмульсии с содержанием дисперсной фазы не более 74% (об.), в которых сохраняется сферическая форма частиц. Эмульсии с содержанием дисперсной фазы больше 74% (об.) называют высококонцентрированными.
Эмульсии являются седиментационно неустойчивыми системами. Если дисперсная фаза и дисперсионная среда отличаются по плотности, то возможна седиментация (или всплытие) капель дисперсной фазы, т.е. нарушение однородности концентрации. Агрегативная неустойчивость эмульсий проявляется в самопроизвольном слиянии капелек в дисперсной фазе – коалесценция. Этот процесс может привести к разрушению эмульсии и разделению её на два жидких слоя.
Эмульсии, как и все микрогетерогенные системы, обладают большой поверхностью раздела фаз. Образование поверхности раздела всегда требует работы, и работа эта тем больше, чем выше поверхностное натяжение на этой поверхности. Поэтому легкость образования эмульсии и повышение ее устойчивости обеспечиваются введением веществ, которые адсорбируясь на границе раздела фаз, уменьшают поверхностное натяжение на ней. Такие вещества называются эмульгаторами.
Наряду с понижением поверхностного натяжения эмульгаторы могут стабилизировать эмульсию также и тем, что на поверхности раздела образуется компактная пленка из эмульгатора, обладающая известной механической прочностью. Такие пленки защищают частицы эмульсии от коалесценции. В отличие от суспензий этот фактор может быть более важным, чем создание на поверхности капелек электрических зарядов.
Рассмотрим подробнее механизм эмульгирования на примере эмульгатора в эмульсии М/В. Полярные (дифильные) молекулы эмульгатора (рис.7, глава 13) адсорбируются на поверхности капельки масла, растворяясь неполярными углеводородными радикалами в масле, а полярными группами в воде. В результате адсорбции эмульгатора поверхностное натяжение капли масла понижается, значит, значение поверхностной энергии уменьшается. В результате система становится устойчивее. Кроме того, образующаяся гидратная клетка прочно свяжет капельки масла с дисперсионной средой (в данном случае с водой), что будет препятствовать коалесценции.
Если в качестве эмульгатора используют молекулы, способные к диссоциации на ионы (например, мыло, представляющее собой смесь жирных кислот), то капелька масла зарядится отрицательно, что приведет к ещё большей стабильности эмульсии.
В качестве эмульгаторов могут быть использованы и твердые вещества, применяемые в виде порошка. В этом случае механизм эмульгирования связан со смачиваемостью порошка жидкостью, входящей в состав эмульсии, и с образованием вокруг капелек твердых прочных оболочек. Гидрофильные эмульгаторы, такие, как глина, мел, гипс, стабилизирую эмульсии типа М/В, а гидрофобные (порошок сажи) – эмульсии типа В/М.
Специфическим свойством большинства эмульсий является взаимное превращение эмульсий двух типов:
М/В↔В/М
Этот процесс, получивший название обращение фаз, приводит к тому, что дисперсная фаза данной эмульсии становится дисперсионной средой вновь образованной системы, а дисперсионная среда данной эмульсии – дисперсной фазой вновь образованной эмульсии. Осуществляется это введением поверхностно-активного вещества, которое стабилизирует обратный тип эмульсии. Например, эмульсию типа М/В, стабилизированную олеатом натрия, переводят в эмульсию В/М введением избытка олеата кальция. Эмульсию бензола в воде, стабилизированную мылом щелочного металла, превращают в эмульсию воды в бензоле прибавлением к ней при встряхивании небольшой массы хлорида кальция. Образующаяся при этом кальциевая соль мыла, хорошо растворимая в бензоле, стабилизирует эмульсию воды в бензоле.
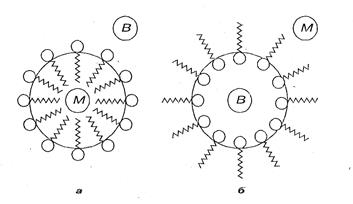
Рис 7 Обращение эмульсий
Обращение эмульсии иногда может быть вызвано длительным механическим воздействием. Так, сбивание сливок (эмульсия типа М/В) приводит к получению масла (эмульсия типа В/М с малым содержанием воды в виде дисперсной фазы).
Биологическое значение эмульсий очень велико. Например, молоко и яичный белок представляет собой эмульсии типа М/В. Усвоение жиров в организме осуществляется через их эмульгирование под влиянием желчи. Млечный сок каучуконосных растений (латекс) также представляет собой эмульсию. Эмульсии находят широкое применение в промышленности: битумные эмульсии для асфальтирования, краски, «режущие эмульсии», используемые при обработке металлов.
Значение суспензий, эмульсий и суспензий в фармации заключается в том, что они входят в обязательный ассортимент лекарств, выпускаемых как по заводской технологии, так и по аптечной технологии. К ним относятся альбихоловая и нафталановая, масляные эмульсии, эмульсии для внутреннего применения; суспензии – линименты синтомициновый, стрептоцидовый, новоциллин и др.; взвеси лиофильных набухающих веществ (танальбин) и лиофобных веществ(камфоры, фенилсалицилата, ментола, серы и до.), пенные препараты против воспаления кожных покровов, ожогов и т.п
Вопрос 5. Строение коллоидных частиц и правила их записи
Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей: мицелл и интермицеллярной жидкости. Мицелла – это структурная коллоидная единица, т.е. частица дисперсной фазы, окруженная двойным электрическим слоем. Интермицеллярной (т.е. межмиццелярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы. Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей.
Предположим, что золь иодида серебра в ходе химической реакции между KNO3 и KI. При этом основу коллоидных частиц составят микрокристаллы труднорастворимого AgI, включающие в себя m молекул AgI (а точнее, m пар ионов Ag+ и I-). Эти микрокристаллы называются агрегатами. Если реакция протекает в присутствии избытка иодида калия, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции n ионов I–. Ионы иодида в таком случае являются потенциалобразующими (сокращенно ПОИ). Агрегат вместе с потенциалобразующими ионами является частицей твердой фазы и его называют ядром. Под действием электростатических сил к ядру притягивается число n ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы K+. Часть противоионов (n–x), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытают действие не только электростатических, но и Ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционный слой противоионов. Остальные х противоионов, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно (т.е. размыто), почему и носят название диффузного слоя. Всё это образование вместе и является мицеллой. Мицеллы золей электронейтральны.

|

|
Структуру мицеллы можно изобразить схемой (рис.6) и записать в виде формулы:
Рис 6 Схема строения мицеллы золя иодида серебра с отрицательно заряженными частицами
Где m-число молекул, входящих в состав агрегата; n-число потенциалобразующих ионов; (n-x) – число протовоионов, входящих в адсорбционный слой; х- число протовоионов, образующих диффузный слой. Числа m, n, и х могут меняться в широких пределах в зависимости от условий получения и хранения золей. Обычно m>>n. Ядро вместе с адсорбционным слоем образует собственно коллоидную частицу или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд, в данном случае отрицательный (х-). Граница между коллоидной частицей и диффузным слоем носит название границы (или поверхности) скольжения. В формуле мицеллы этой границе соответствует фигурная скобка между адсорбционным и диффузным слоями. Граница разрыва обозначает ту геометрическую поверхность, по которой происходит разделение (разрыв) мицеллы на коллоидную частицу и диффузный слой в случае её перемещения относительно дисперсионной среды (например, при участии мицеллы в броуновском движении или при движении под действием электрического поля).
Вопрос 6. Применение дисперсных систем в биологии и медицине.
С фармацевтической точки зрения наиболее важным свойством коллоидных растворов является высокая степень их лабильности. Под влиянием часто ничтожных причин, например прибавления незначительного количества электролитов, нагревания, механической обработки, света, повышения температуры, а иногда самопроизвольно без каких-либо видимых причин коллоидные растворы подвергаются разрушению - коагуляции. При коагуляции частицы растворенного вещества укрупняются, золь сильно мутнеет, превращается в суспензию и спустя короткое время выделяет осадок - коагулят. Иногда при коагуляции жидкие золи застывают, превращаясь в прозрачные, более или менее прочные студни - гели. Даже при самом бережном хранении золи имеют ограниченный срок существования, с течением времени подвергаются старению и в конце концов коагулируют или желатинируются.
В настоящее время практическое применение находят лишь некоторые препараты защищенных коллоидов, обладающих обратимостью и спонтанностью растворения и относительной (как правило, невысокой) устойчивостью, и некоторые коллоидные электролиты. Значение суспензий, эмульсий и суспензий в фармации заключается в том, что они входят в обязательный ассортимент лекарств, выпускаемых как по заводской технологии, так и по аптечной технологии. К ним относятся альбихоловая и нафталановая, масляные эмульсии, эмульсии для внутреннего применения; суспензии – линименты синтомициновый, стрептоцидовый, новоциллин и др.; взвеси лиофильных набухающих веществ (танальбин) и лиофобных веществ(камфоры, фенилсалицилата, ментола, серы и до.), пенные препараты против воспаления кожных покровов, ожогов и т.п
3. Самостоятельная работа студентов. 25 мин
Тест: «Строение коллоидной частицы»
Пример варианта.
Вариант №2
К водному раствору AgNO3 медленно прибавляют водный раствор NaCl, пока не произойдет образование коллоидного раствора. Составьте схему строения мицеллы, ответьте на вопросы:
1.Какие ионы адсорбируются вокруг ядра:
а) Na+ б) Ag+ в) Cl- г) NO3-.
2.Какие ионы входят в состав адсорбционного слоя, являющиеся одновременнопротивоионами:
а) Na+ б) Ag+ в) Cl- г) NO3-.
3.Какой заряд ядра и слоя потенциалопределяющих ионов:
а) положительный б) отрицательный в) нейтральный
4.Укажите заряд гранулы:
а) положительный б) отрицательный в) нейтральный
5.Какие ионы входят в состав диффузионного слоя:
а) Na+ б) Ag+ в) Cl- г) NO3-.
6.Указать заряд мицеллы:
а) положительный б) отрицательный в) нейтральный
4. Задание на дом 5 мин
5.Уборка рабочего места 10 мин
Дата добавления: 2015-02-16; просмотров: 47 | Поможем написать вашу работу | Нарушение авторских прав |