
Читайте также:
|
При КО катализе возникновение активного комплекса связано либо с переходом от катализатора протона к реагенту, либо с отдачей реагентом протона катализатору. На стадии восстановления состава катализатора протон перемещается в обратном направлении.
Пример: гидролиз сложного эфира катализатор (кислота), предавая сложному эфиру протон, переводит его в протонированную форму, обладающую более высокой реакционной способностью. Протонированная молекула сложного эфира
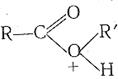
значительно легче гидролизуется водой по реакции
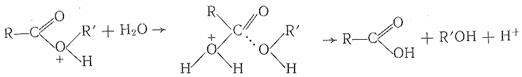
чем исходная молекула эфира.
II. Окислительно-восстановительный катализ
При реакциях ОВ катализа образование активного комплекса связано с электронными переходами между катализатором и реагентом.
Пример: Разложение перекиси водорода, ускоряемая ионами железа. Процесс протекает в несколько стадий.
Первая стадия приводит к образованию очень реакционноспособного гидроксильного радикала, несущего один неспаренный электрон:

Этот радикал взаимодействует с другой молекулой пероксида, получается новый радикал:
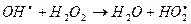
Этот радикал распадается на протон и анион-радикал кислорода:
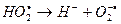
Последний реагирует с ионом железа (III), восстанавливая его, а сам превращается в молекулу кислорода:

Таким образом, железо после окончания процесса оказывается в первоначальном состоянии в результате протекания окислительно-восстановительной реакции.
Дата добавления: 2015-02-16; просмотров: 67 | Поможем написать вашу работу | Нарушение авторских прав |