
Читайте также:
|
Мы хорошо знаем, что многие процессы происходят самопроизвольно, то есть без внешних воздействий, когда система предоставлена самой себе. Вода стекает по склону; газы распространяются из области высокого давления в область низкого; химические реакции доходят до равновесия; теплота передается от более нагретого тела к менее нагретому. Всякий самопроизвольный процесс можно использовать, по крайней мере, в принципе, для получения полезной работы. Например, падающая вода может вращать турбину, расширяющийся газ - двигать поршень, химическую реакцию можно использовать как источник энергии в батарее, горячие и холодные резервуары необходимы, чтобы заставить работать тепловые машины. Поскольку при самопроизвольных процессах можно получить работу, очевидно, что в ходе самопроизвольного перехода система теряет способность производить полезную работу.
Экспериментально установлено, что самопроизвольные процессы необратимы в том смысле, что не могут протекать в обратном направлении сами по себе; например, вода не течет вверх по склону. Термин несамопроизвольные применяется к процессам, обратным по отношению к самопроизвольным, например к воде, текущей вверх по склону. Несамопроизвольные переходы могут происходить только при введении в систему энергии извне. Например, чтобы перекачать воду наверх, сжать газ или перенести теплоту из холодной части системы в горячую (как в холодильной машине), необходимо затратить энергию. Так как требуемую энергию можно получить с помощью самопроизвольного процесса, то становится очевидно, что обращение самопроизвольного процесса возможно лишь при использовании энергии, получаемой при другом самопроизвольном процессе.
Самопроизвольные процессы могут протекать или обратимо, или необратимо. Хотя значение этих терминов уже обсуждалось ранее, стоит снова вернуться к ним. Чтобы самопроизвольный переход протекал обратимо, необходимо приложить извне такое сопротивление, чтобы переход был очень медленным и фактически в любое время мог бы пойти в обратном направлении при бесконечно малом изменении противодействующей силы. Примерами таких идеальных обратимых процессов в случае самопроизвольно происходящих изменений могут служить: расширение газа в идеальном поршне при медленном изменении противодействующего давления; разрядка батареи через потенциометр, дающий разность потенциалов противоположного знака.
В случае обратимо протекающих изменений производится максимальное количество работы. В действительности невозможно получить максимальную работу ни в одной из систем с реальной машиной из-за потерь на трение и из-за того, что истинно обратимый процесс должен протекать бесконечно медленно. Таким образом, реальные процессы всегда в какой-то степени необратимы, и получаемая работа всегда меньше максимально возможного теоретического количества. Реальное количество работы, которое действительно получается при самопроизвольном переходе, может иметь любое значение, начиная от нуля (например, когда газ расширяется в вакууме или когда химическая реакция происходит в лабораторном стакане) и до максимальной величины, если процесс проводится обратимо.
Энтропия.
Второй закон термодинамики можно сформулировать многими, казалось бы совершенно различными, способами; но в действительности все формулировки эквивалентны. Наиболее полезная для физико-химических целей форма второго закона выражена через новую термодинамическую функцию – энтропию.
Энтропия - это экстенсивная термодинамическая величина; обозначается символом S. Она является функцией состояния системы и обладает следующими свойствами:
- для бесконечно малых обратимых изменений системы
 (5.1)
(5.1)
- для бесконечно малых самопроизвольных изменений системы
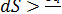 (5.2)
(5.2)
Очевидно, что энтропия имеет размерность энергии, деленной на температуру; обычно она выражается в кал/моль∙град. Обозначение δq употребляется вместо dq, чтобы показать, что q не является полным дифференциалом и зависит от пути перехода. Соотношения (5.1) и (5.2) также определяют абсолютную шкалу температуры Т, для которой только и верны эти соотношения.
Энтропия - функция состояния системы, и поэтому ее значение не зависит от предыстории системы, а изменение энтропии при данном изменении состояния не зависит от пути перехода. Однако, поскольку уравнение (5.1) применимо только к обратимым процессам, изменение энтропии можно рассчитать лишь на основании значений теплоты и температуры, измеренных в процессе обратимого перехода. Изменение энтропии для конечного перехода от состояния 1 к состоянию 2 выражается интегралом уравнения (5.1), взятым вдоль пути обратимого перехода
 (5.3)
(5.3)
Дата добавления: 2015-04-20; просмотров: 116 | Поможем написать вашу работу | Нарушение авторских прав |