
Читайте также:
|
В 1923 г. независимо друг от друга И. Бренстед и Т. Лоури предложили новую, так называемую протолитическую теориюкислот иоснований, которую чаще называют просто теорией И. Бренстеда. Эта теория является стройным физико-химическим учением о кислотности-основности, в которой обобщен обширный материал о протолитических реакциях, протекающих в любых растворителях. Авторы этой теории считают, что электролитическая диссоциация кислот и оснований не является физическим процессом отщепления ионов Н+ и ОН–, как это вытекало из теории Аррениуса, а есть результат химического взаимодействия растворенного вещества с растворителем. Например:

Явление распада вещества на ионы в результате химического взаимодействия с растворителем может быть проиллюстрировано растворением различных аминов в органических кислотах. Как известно, ни амины, ни органические кислоты в чистом виде практически не диссоциированы. Если же смешать амины с органической кислотой, то (как впервые показал Д. П. Коновалов) полученный раствор будет хорошо проводить электрический ток, так как в процессе реакции образуются ионы:
R'NH2 + RCOOH «[R'NH3]+[RCOO]– «R'NH3++ RCOO–
Учитывая все эти факты, Бренстед называет кислотами вещества, которые способны отдавать протон (доноры протона):
кислота А 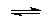 основание В + Н+,
основание В + Н+,
например, HClO4  ClO4– + Н+
ClO4– + Н+
Основаниями, по Бренстеду, являются вещества, которые способны присоединять протон (акцепторы протона):
основание В + Н+  кислота А, например, NH3 + H+
кислота А, например, NH3 + H+  NH4
NH4
Реакцию кислотно-основного взаимодействия Бренстед представляет следующей схемой:
кислота1+ основание2  основание1 + кислота2,
основание1 + кислота2,
например, HCl + NH3  Cl– + NH4+
Cl– + NH4+
В этом равновесии участвуют две пары кислот и оснований, именуемых И. Бренстедом корреспондирующими, т. е. сопряженными,или соответствующими. Так, в указанной реакции С1--ион является сопряженным основанием кислоты НСl; NH4+-ион – сопряженной кислотой основания NН3. Таким образом, вещество может проявлять кислотность лишь при взаимодействии с основанием и, наоборот, основные свойства оно может обнаруживать только в присутствии кислоты. Бренстед проводит аналогию между кислотно-основными и окислительно-восстановительными реакциями. При окислительно-восстановительных реакциях от восстановителя к окислителю переходит электрон, а при кислотно-основных реакциях кислота отдает основанию протон. Подобно тому, как кислота, отдав протон, превращается в основание, восстановитель, потеряв электрон, становится окислителем.
восстановитель  окислитель + электрон
окислитель + электрон
кислота  основание + протон
основание + протон
Как для протекания восстановительной реакции необходимо присутствие окислителя, принимающего электрон, так и для проявления кислотности вещества необходимо присутствие основания, способного принять протон. Таким образом, одно и то же вещество в зависимости от условий реакции может быть и кислотой, и основанием. Например, в приводимых ниже реакциях вода ведет себя как слабое основание, так как она является акцептором протона:


Но вода может проявлять и кислотные свойства, т.е. быть донором протона:

Уксусная или азотная кислоты ведут себя как кислоты по отношению к более слабым кислотам. Например, при взаимодействии уксусной кислоты с безводной азотной уксусная кислота действует как основание.

В свою очередь даже такая кислота как азотная по отношению к более сильной, например, хлорной кислоте (в водном растворе) ведет себя как основание:

Наглядным примером зависимости свойства вещества от партнера (растворителя) служит мочевина, которая в жидком аммиаке ведет себя как кислота, в уксусной кислоте — как основание, а в воде — нейтральна. Вещества, способные легко присоединять к себе протоны, называются протофильными и являются основаниями. Если такие вещества служат растворителями, то называются протофильными растворителями (жидкий аммиак, амины). Чем сильнее выражена протофильность растворителя, тем большее число веществ, растворенных в нем, ведут себя как кислоты, тем отчетливее проявляется различие в их силе и тем меньшее число оснований способно существовать в этом растворителе.
Вещества, способные отдавать протоны, называются протогенными и являются кислотами (серная, азотная, уксусная кислоты). Если они являются растворителями, то называются протогенными растворителями. Чем легче молекулы растворителя отдают протоны, тем большее число веществ сможет проявить в этом растворителе основные свойства. Вода является типичным амфотерным растворителем. Она примерно с одинаковой легкостью может присоединять и отдавать протон:
HNO3 + H2O  H3O+ + NO3–
H3O+ + NO3–
NH3 + H2O  NH4++ OH–
NH4++ OH–
По Бренстеду, существуют и так называемые апротонные растворители. Это вещества, которые или совсем не проявляют кислотные и основные свойства, или проявляют их очень слабо. Они не способны отдавать или принимать протоны. К таким растворителям Бренстедотносит бензол и большинство углеводородов. Таким образом, теория кислот и оснований Бренстеда значительно расширила круг веществ, которые можно рассматривать как кислоты или основания не только в воде, но и в неводных средах. Протолитическая теория хорошо объясняет реакции кислотно-основного взаимодействия как в водных, так и в неводных системах, а также взаимодействие между кислотами различной силы, чего невозможно было объяснить, опираясь на теорию Аррениуса
Однако дальнейшее развитие химической науки показало, что и эта теория является несовершенной, так как в ней не нашлось места апротонным кислотам. Между тем, на практике часто встречаются реакции, которые носят кислотно-основной характер, тогда как ни одно из участвующих в реакции веществ не является донором протона. Количественная теория кислот и оснований Бренстеда во многих случаях не совпадает с опытными данными.
Дата добавления: 2015-09-11; просмотров: 52 | Поможем написать вашу работу | Нарушение авторских прав |