
Читайте также:
|
Кислотность и основность существуют не сами по себе, а являются свойствами относительными. Кислотный характер может проявиться лишь в присутствии основания, и, наоборот, основной характер – только в присутствии кислоты. При реакции кислоты с каким-либо основанием возникает основание, сопряженное с исходной кислотой,и кислота,сопряженная с исходным основанием:
А–Н + В:  А:– + В–Н+
А:– + В–Н+
кислотаоснованиесопряженноесопряженная
основаниекислота
Так например,газообразный хлористый водород не является кислотой: он становиться ею только в присутствии акцептора протонов, т.е. основания, например воды. Проявляет ли амфотерное вещество (т.е. вещество, способное как отщеплять протоны, так и присоединять основания) свойства кислоты или основания, зависит исключительно от химического окружения. Например,по отношению к сильным основаниям вода ведет себя как кислота, отщепляя протон; по отношению же к очень слабым основаниям (образующим очень сильные сопряженные кислоты) вода выступает как основание. Любое соединение R-H, в том числе и углеводороды, может проявить свойства кислоты, если только найти достаточно сильное основание, связывающее протон сильнее, чем это делает остаток R-. Амфотерные соединения, например вода и карбоновые кислоты, образуют свои собственные акцепторы протонов:
H2O+H2O=HO–+H3O+
Это называется автопротолизом. Кислотность и основность соединения зависят от основности (соответственно кислотности) растворителя. Поэтому при сравнении соответствующих констант всегда надо указывать растворитель. В сильноосновном растворителе и сильные и слабые кислоты в значительной степени диссоциированы, больших различий между ними не наблюдается; такой растворитель нивелирует кислотность. Аналогично обстоит дело с основаниями в кислотных растворителях. Очень слабые кислоты можно исследовать только в растворителе, более основным, чем вода: такими растворителями могут быть жидкий аммиак, амины. Для очень слабых оснований надо выбирать растворители, более кислые, чем вода: это, например безводная уксусная кислота.
Интенсивность кислотно-основного взаимодействия характеризуется, в первую очередь, константой равновесия. Чем сильнее кислота (основание), взаимодействующая с заданным основанием (кислотой), тем больше сдвинуто кислотно-основное равновесие в сторону образования сопряженного основания (кислоты). Если в качестве стандарта сравнения принять какую-либо конкретную пару сопряженных кислоты и основания, то любая другая пара в том же растворителе и при тех же условиях может быть охарактеризована соответствующей константой равновесия, например:
А–Н + H2O 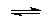 А:– +Н3О+
А:– +Н3О+
В этом уравнении не учтено, что протон существует в виде Н5О2+ и для реакции необходимы две молекулы H2O. Константа равновесия выражается следующим образом:
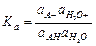
где a – термодинамические активности соответствующих частиц.
Кислотность разных кислот можно измерить лишь относительно какой-либо произвольно выбранной пары сопряженных кислот и основания. Таким стандартом сравнения принята пара Н3О+ — Н2О в водном растворе при 25оС. Определение кислотности (основности) проводят обычно в разбавленном растворе, так как при этом активности частиц можно заменить на их концентрации. Кроме того, поскольку растворитель (вода) присутствует в избытке, то его концентрация (величина практически постоянная 55 М) включается в константу равновесия. С учетом этого выражение для константы диссоциации кислот принимает вид:
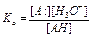
Соответственно основание В: характеризуется равновесием:
B:+H2O  BH++ OH–
BH++ OH–
и константой равновесия:

Вместо величин Ка и Kb по аналогии с водородным показателем рН чаще используют соответствующие значения pK = – lgK. Численные значения этих величин для сопряженных кислот и оснований приведены в табл. 1.
Таблица 1
Значения рКа и рКb сопряженных кислот и оснований
в разбавленных водных растворах.
| рКа | Кислота | Основание | рКb |
| -5 | HClO4 | ClO4– | |
| -2.8 | H2SO4 | HSO4– | 16.8 |
| -1,74 | H3O+ | H2O | 15.74 |
| -1.32 | HNO3 | NO3– | 15.32 |
| 1.26 | H2C2O4 | HC2O4– | 12.74 |
| 1.92 | H2SO3 | HSO3– | 12.08 |
| 1.96 | HSO4– | SO4–2 | 12.04 |
| 2.12 | H3PO4 | H2PO4– | 11.88 |
| 3.14 | HF | F– | 10.86 |
| 3.35 | HNO2 | NO2– | 10.65 |
| 4.76 | CH3COOH | CH3COO– | 9.74 |
| 7.05 | H2S | HS– | 6.95 |
| 7.20 | H2PO4– | HPO4–2 | 6.80 |
| 7.25 | HClO | ClO– | 6.75 |
| 9.24 | H3BO3 | H2BO3– | 4.76 |
| 9.25 | NH4+ | NH3 | 4.75 |
| 9.22 | HCN | CN– | 4.78 |
| 10.33 | HCO3– | CO3–2 | 3.67 |
| 11.62 | H2O2 | HO2– | 3.38 |
| 12.32 | HPO42– | PO43– | 1.68 |
| 15.74 | H2O | HO– | -1.74 |
| NH3 (жидк.) | NH2– | -19 | |
| 38.6 | H2 | H– | -24.6 |
| CH4 | CH3– | -44 |
Чем меньше (чем отрицательнее) рКа, тем сильнее кислота и слабее сопряженное основание. В водном растворе основность и кислотность связаны через ионное произведение воды:
рКа = 14 – рКb и рКb = 14 – рКa
С точки зрения практики оказалось удобнее выражать основность веществ через константу диссоциации сопряженной кислоты, то есть:
В–Н++ H2O  В:+ Н3О+
В:+ Н3О+

Чем больше значение pKBH+, тем сильнее основание. В последнее время все чаще стали опускать индекс BH+ и писать вместо него «a», то есть характеризовать силу основания тоже величиной рКа, но ее не следует путать с рКа кислоты.
Величины рКа можно легко определить методами потенциометрии и спектрофотометрии. Влияние среды на кислотность и основность органических соединений будет рассмотрено ниже.
Дата добавления: 2015-09-11; просмотров: 30 | Поможем написать вашу работу | Нарушение авторских прав |