
Читайте также:
|
Наиболее очевидным было использование ЭПР для исследования химических процессов, протекающих при участии свободных радикалов.
Как хорошо известно, свободные радикалы были открыты американским ученым Гомбергом в 1900 г., когда при исследовании реакций гексафенилэтана (Ph)3C — C(Ph)3 ему пришлось предположить существование в качестве самостоятельного химического образования частиц (Ph)3c, обладающих трехвалентным углеродом. Предположение об образовании свободных радикалов-частиц с ненасыщенным атомом углерода позволило объяснить большое число химических фактов — образование продуктов димеризации, ряд кинетических особенностей сложных процессов [21]..
В 1918 г. Нернстом было высказано предположение, что свободные радикалы играют существенную роль не только в жидкофазных превращениях, но и в быстрых газовых реакциях. Было получено много косвенных доказательств этого предположения, но только в начале 30-х годов были разработаны первые прямые — спектроскопические — методы обнаружения радикалов в ходе химических реакций — свободного гидроксила в зоне разреженных пламени водорода и окиси углерода.
После этого центр тяжести при исследовании роли радикалов как промежуточных продуктов при сложных химических процессах надолго перемещается в область газофазных реакций. Наряду со спектрами поглощения и излучения для этой цели начали успешно использовать масс-спектральный метод. Вопрос же об идентификации свободных радикалов в конденсированной фазе (в жидких и твердых средах) и об изучении их химических свойств до начала 50-х годов оставался практически нерешенным. Единственным источником наших сведений о строении этих частиц были косвенные химические данные, основанные на анализе конечных продуктов. Только в некоторых случаях — при образовании радикалов в концентрациях больше 5—10% от концентрации исходных веществ—возможно пользоваться для этой цели непосредственным измерением парамагнитной восприимчивости. Последний метод не позволял, однако, сделать почти ниаких выводов о природе парамагнитной частицы. Положение резко изменяется после открытия метода электронного парамагнитного резонанса, позволяющего изучать радикалы в самых различных средах. Применение метода ЭПР для исследования строения и превращения свободных радикалов в ходе химических реакций ограничивается в настоящее время чувствительностью метода [21].
В последнее время этот прием был применен В. Н. Панфиловым, В. В. Азатяном, А. Б. Налбандяном для доказательства образования сверхравновесных концентраций атомов водорода в пламени окиси углерода с небольшими добавками молекулярного водорода. Более того, поскольку из химического механизма горения СО следует, что в этом пламени должны образовываться очень высокие концентрации атомов кислорода, В. В. Азатян и А.Б. Налбандян поставили опыты по прямой идентификации атомов кислорода в зоне горения. Результаты этих опытов также полностью подтвердили выводы теории цепных реакций. Хотя применение ЭПР для исследования сверхбыстрых газовых реакций и представляет несомненный интерес, однако развитие этой области еще только начинается, и других данных, позволяющих сравнить этот метод пока нет [21]..
Метод ЭПР начинает применяться и при исследовании радикалов в жидкофазных реакциях. Правда, по отмеченным выше причинам, область применяемости его ограничивается в большинстве случаев сравнительно малоактивными радикалами и ионами-радикалами. При этом довольно часто, как известно, радикалы можно рассматривать практически как совершенно устойчивые продукты и изучать их химическими методами или простым магнитным взвешиванием. В этих случаях ЭПР играет, тем не менее незаменимую роль, поскольку он позволяет точно установить истинную структуру радикала (или иона-радикала). Так, применение метода ЭПР позволило точно установить строение ион-радикалов различных семихинонов, ароматических положительных и отрицательных ионов-радикалов и многих других малоактивных парамагнитных частиц. Мы вернемся еще к рассмотрению этих результатов при анализе вопроса о распределении спиновой плотности неспаренного электрона [21]..
Если говорить о кинетических измерениях в жидкостях с помощью ЭПР, то следует прежде всего рассмотреть один пример, который можно назвать промежуточным. Радикал, о котором идет речь (трифенил-метил), настолько устойчив, что его концентрация достигает нескольких процентов от гексафенилэтана, но сведения о его концентрациях и о скоростях его превращения были получены до сих пор только на основе косвенных химических измерений. Поскольку спектр ЭПР трифенилметила имеет весьма характерный и специфический вид, он представляется весьма удобным объектом для проведения строгих количественных кинетических измерений. В проведенных в ИХФ в 1958 г. работах Ф. С. Дьячковского, Н. Н. Бубнова, А. Е. Шилова были поставлены две задачи [21]:.
1. Непосредственное измерение константы равновесия

и константы скорости рекомбинации трифенилметильных радикалов в интервале температур, достаточно широком для точного определения энергии связи Q в гексафенилэтане и энергии активации процесса рекомбинации Е..
2. Прямое подтверждение гипотезы Н. Н. Семенова о возможности образования радикалов при бимолекулярной реакции:

в тех случаях, когда связь В — С значительно прочнее связей АВ и CD. В качестве примера была выбрана реакция
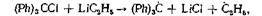 ,
,
за ходом которой можно было следить по накоплению устойчивого радикала (Ph)3C.
Для решения первой задачи измерения проводились в разбавленных растворах гексафенилэтана в толуоле, непосредственно после их быстрого охлаждения от комнатной температуры до температуры опыта..
На рис. 8 приведены кинетические кривые исчезновения радикалов (Ph)3C при двух температурах: — 50 и — 64° С. Точки вполне удовлетворительно описываются законом второго порядка, что позволило определить величины констант скорости и, проводя опыты при различных температурах, энергию активации — 
Из предельных значений [(Ph)3C]¥, полученных при различных температурах, было найдено выражение для константы равновесия:

Необходимо отметить, что полученные таким путем значения Е и Q почти тождественны величинам, определенным ранее из химических данных.
На рис. 8 приведены данные, полученные Ф. С. Дьячковским, Н. Н. Бубновым, А. Е. Шиловым при изучении реакции..

Рис. 8. Кинетика рекомбинации трифенилметильных радикалов..

Рис.9. Кинетические кривые измерения концентрации радикалов (Ph)3C в ходе реакции (Ph)3CCl+LiC2H5..
Несмотря на огромный интерес, который представляет метод ЭПР для исследования химических превращений, протекающих в жидкой фазе при участии радикалов, и для установления детальных механизмов этих превращений, насколько нам известно, имеется еще лишь два систематических исследования в этом направлении. Это работы американских ученых Гарднера и Френкеля по превращениям в жидкой сере и работа Я. С. Лебедева, В. Ф. Цепалова, В. Я. Шляпинтоха по идентификации свободных радикалов при жидкофазном окислении кумола.
В первом из этих исследований было найдено, что при нагревании жидкой серы возникают свободные радикалы, обусловленные разрывом полимерных цепочек серы. Из самого факта обнаружения этих радикалов в заметных концентрациях следует, что либо подвижность их в жидкой сере весьма невелика, либо они представляют собой своеобразные «клубки», причем свободная валентность размещена в центре такого клубка, что и объясняет ее малую активность и, как следует из этого, достаточно высокую стационарную концентрацию [21]..
Следует отметить, что совершенно идентичные по форме линии спектры наблюдались авторами статьи при применении в качестве инициаторов окисления столь различных веществ, как азоизобутиронитрил и дицикло-гексилперкарбонат, и при каталитическом инициировании в присутствии стеарата кобальта.
Концентрация радикалов с точностью до 50% совпадала с рассчитанной теоретически и однозначно определялась значением скорости процесса окисления. Из этого следует, что спектр ЭПР обусловлен радикалом цепи окисления, а не влиянием добавок. Весьма удивительно, что, несмотря на то, что измерения проводились в жидкой фазе, усреднение анизотропии g-фактора за счет вращения не наблюдается.
Явно недостаточное развитие работ по применению ЭПР для исследования механизма химических реакций связано, по-видимому, с тем, что до сих пор применением метода ЭПР в химии занимались в основном физики, которые ограничивались установлением строения химических частиц и не чувствовали вкуса к решению кинетических задач. Совершенно ясно, что эта область в ближайшее время будет очень интенсивно развиваться [21]..
Дата добавления: 2015-09-11; просмотров: 31 | Поможем написать вашу работу | Нарушение авторских прав |