
Читайте также:
|
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
| Реакции по связи О – Н | Реакционная способность одноатомных спиртов в реакциях по связи О–Н: CH3OH > первичные > вторичные > третичные. |
| 1.Одноатомные спирты реагируют с активными металлами (Na, K, Mg), образуя соли - алкоголяты (алкоксиды): | 2R–OH + 2Na ->2RO–Na+ + H2 2C2H5OH + 2K ->2C2H5O–K+ + H2 этилат калия (алкоголят) Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла: C2H5OК + H2O ->C2H5OH + КOH |
| 2.Окисление одноатомных спиртов. | 1) Горение: 2CH3OH + 3O2 ->2CO2 + 4H2O
2) Окисление первичных спиртов до альдегидов:
Реагенты – CuO (to), O2 (Cu, to), а также дегидрирование при нагревании над медной сеткой.
СН3-СН2-ОН +СuO –(to)-> CH3-C=O + Cu + H2O
этанол ô этаналь
H
2*) Дегидрирование:
СН3-СН2-СН2-ОН –(Сu, to)-> CH3-CH2-C=O + H2
пропанол ô пропаналь
H
3) Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот:
СН3-СН2-ОН + KMnO4 + H2SO4 -> CH3-COOH + MnSO4 + K2SO4 +H2O уксусная кислота
4) Окисление подкисленным раствором дихромата калия
3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO  + K2SO4 + Cr2(SO4)3 + 7H2O
5) При окислении вторичных спиртов любым окислителем образуются кетоны. + K2SO4 + Cr2(SO4)3 + 7H2O
5) При окислении вторичных спиртов любым окислителем образуются кетоны.
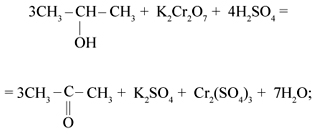
|
| Реакции по связи С–О | Реакционная способность одноатомных спиртов в реакциях по связи С–О: третичные > вторичные > первичные > CH3OH |
| 1. Реакции замещения ОН на галоген: происходит в реакции с галогеноводородами в присутствии сильной кислоты (конц. H2SO4). |
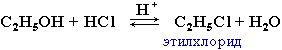
|
| 2.Реакции дегидратации спиртов: 1)Внутримолекулярная дегидратация: образуются алкены. | Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре:
 Правило Зайцева – водород отщепляется от менее гидрогенизированного атома углерода.
Правило Зайцева – водород отщепляется от менее гидрогенизированного атома углерода.
|
| 2) Межмолекулярная дегидратация: образуются простые эфиры. | При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы.
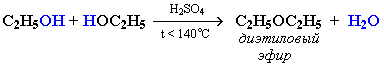
|
| 3) Образование сложных эфиров. | Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

|
Дата добавления: 2015-09-11; просмотров: 16 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ. | | | ХИМИЧЕСКИЕ СВОЙСТВА. |