
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное
Учреждение высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Кафедра генетики микробиологии и биотехнологии
КУРСОВАЯ РАБОТА №2
Молекулярно-генетические методы для выявления генов устойчивости пшеницы к возбудителям ржавчины
Работу выполнил..............................................................Попов Фёдор Михайлович
Факультет биологический
Направление 020201 Биология
Научный руководитель……………..………………..Карасева Эмма Викторовна
Нормоконтролёр………………………………….…Вяткина Галина Григорьевна
Содержание
Обозначения………………………………………………………………………....5
Введение……………………………………………………………………………..6
1. Аналитический обзор…………………………………………………………….8
2.Материалы и методы……………………………………………………………..14
2.1.Объект исследований……………………………………………………….….14
2.2.Растворы и буферы……………………………………………………………..14
2.3.Выделение и подготовка ДНК к анализу……………………………………..14
2.3.1Экстракция тотальной растительной ДНК………………………………….14
2.4.Полимеразная цепная реакция………………………………………………...16
2.5.Электрофорез………...…………………………………………………………16
3.Молекулярно-генетические методы для выявления генов устойчивости пшеницы к возбудителям ржавчины……………………………………………...18
4.Заключение………………………………………………………..………………29
5.Список использованных источников……………………………………………30
Определения, обозначения, сокращения
ПЦР – Полимеразная цепная реакция
Праймер (англ. primer) — это короткий фрагмент нуклеиновой кислоты (олигонуклеотид), комплементарный ДНК- или РНК-мишени, служит затравкой для синтеза комплементарной цепи с помощью ДНК-полимеразы (при репликации ДНК)
праймер F (forward) - комплементарен переднему (5’) концу требуемого фрагмента ДНК
праймер R (reverse) - комплементарен заднему (3’) концу требуемого фрагмента ДНК
К – контроль(ДНК содержащая искомый ген)
Кч – контроль чистый - ПЦР смесь не содержащая ДНК
Маркер - линейные фрагменты ДНК известной длины(ДНК «линейка»)
bp -base pair - пара нуклеотидов (оснований). Элементарная единица двухцепочечной молекулы нуклеиновой кислоты
CTAB -ЦТАБ Цетилтриметиламмоний бромид
dd – дважды дистиллированый
DNTP mix - Дезоксирибонуклеозидфосфаты (dATP, dGTP, dCTP, dTTP).
Master mix – мастер микс – расчетная унифицированная смесь для проведения ПЦР исследования и последующего электрофореза, в расчете 25 мкл р-ра на одну пробирку.
10x buffer – р-р сульфатов и бычий сывороточный альбумин.
TBE - Tris/Borate/EDTA - Трис(гидроксиметил)аминометана / Соли борной кислоты/ Этилендиаминтетрауксусная кислота
EDTA – ЭДТА - Этилендиаминтетрауксусная кислота
Введение
В Северо-Кавказском регионе ведущее место в севооборотах хлебных злаков занимает озимая пшеница (3500-4500 тыс.га), что обеспечивает до 20 % валового сбора зерна в России. Эта культура подвержена воздействию большого комплекса фитопатогенов, среди которых возбудители бурой (Puccinia triticina Rob.ex Desm. f.sp. tritici Erikss. et Henn .), желтой ржавчины (Puccinia striiformis West. f.sp. tritici Erikss. еt Henn.),стеблевой ржавчины (Puccinia graminis Pers. f.sp. tritici Erikss. еt Henn.) занимают преобладающее место.
Для разработки научно обоснованной стратегии создания и размещения сортов требуется запас генетически разнообразных доноров устойчивости. Источниками новых доноров могут служить образцы с известными генами устойчивости, представленными в ‹‹Каталоге генных символов…›› (McIntosh et al.,). Традиционными методами идентификации этих генов являются анализ родословной, который позволяет выявить использованный в скрещиваниях источник устойчивости, фитопатологический тест с помощью изолятов, маркированных вирулентностью к идентифицируемому гену, и гибридологический анализ(Методы селекции оценки…1988).
По данным Гультяевой с сотрудниками среди районированных в России 100 озимых и 131 яровых сортов пшеницы обнаружено низкое генетическое разнообразие по эффективным Lr-генам: подавляющее большинство устойчивых сортов несут Lr9 и Lr19 (Гультяева и др., 2009). Однако не было выявлено российских сортов с высоко эффективными возрастным геном Lr37 и проростковыми генами Lr21, Lr25, Lr29 и Lr39, что показывает их значимость для дальнейшего использования в селекции.
В ряде регионов России, в частности на северном Кавказе, эффективны гены устойчивости Lr9, Lr19, Lr24, Lr29, Lr42, а к генам Lr52 (LrW) и Lr45 наблюдается низкая частота встречаемости вирулентных изолятов (около 2-3%) (Volkova, 2009). Тем не менее, к северо-западной российской популяции ген Lr52 неэффективен (Курбанова, 2011). По последним данным изучения вирулентности популяции гриба на Северном Кавказе для селекции в этом регионе предложены гены Lr9 и Lr24 (Кудинова, 2012).
Принципиально новые возможности появились с начала 1990-х годов с созданием ДНК-маркеров селекционно-ценных признаков. Первый молекулярный маркер был предложен G. Schachermayr с соавторами (1994) для идентификации гена устойчивости к бурой ржавчине. Потребности практической селекции определили усиленное развитие исследований по созданию новых маркеров, в связи с чем список предлагаемых генов ежегодно пополняется. Особую значимость ДНК-маркеры приобрели при идентификации 1) высоко эффективных генов устойчивости, определение которых затруднено из-за отсутствия в популяции патогена вирулентных изолятов; 2) генов устойчивости взрослых растений и 3) малоэффективных генов, получивших широкое использование в стратегиях пирамидирования при создании сортов с неспецифической устойчивостью.
Цель работы: провести анализ сортов мягкой пшеницы на наличие генов устойчивости методом ПЦР-анализа.
Задачи работы:
•выявить наличие генов устойчивости пшеницы к ржавчинным заболеваниям
•определить наиболее перспективные сорта пшеницы
1.Аналитический обзор
В начале XX века Н. И. Вавилов начал свою научную деятельность с изучения устойчивых к заболеваниям сортов культурных пшениц. Это была задача чрезвычайной важности, так как от фитопаразитов, в частности ржавчины и мучнистой росы, погибает около 30% урожаев пшеницы. Эти болезни вызываются грибами, их распространение в иные годы приводит к эпифитотиям (по аналогии с эпизоотиями и эпидемиями), когда погибает урожай целых регионов. Вавилов предлагал выявлять природные устойчивые сорта и скрещивать их с культурными, высокопродуктивными растениями. В поисках резистентных сортов Вавилов предпринял несколько экспедиций в Центральную Азию, и в этих экспедициях, как мы помним, сформулировал принципы очагов происхождения культурных растений и законы гомологических рядов. Там же, в очагах происхождения, нашлись и резистентные культурные, и дикие сорта. Далее последовала селекционная работа на опытных полях, и в результате удалось вывести целый ряд устойчивых к заболеваниям сортов культурных растений(Вавилов Н.И.,1986).
Большинство селекционеров и фитопатологов выступают за генетическое разнообразие и против генетической узости сортов. Уязвимость сортов, частые вспышки массовых эпифитотий являются следствием генетической однородности сортов и использования в селекции одних и тех же или ограниченного числа генов устойчивости (Кривченко, 1981).
Урожайность мягкой пшеницы во многом зависит от устойчивости возделываемых сортов к неблагоприятным абиотическим и биотическим факторам, поэтому перед селекционерами стоит задача создания сортов, которые сочетают в себе генетические структуры высокой продуктивности с системами, обеспечивающими минимальные потери урожая от воздействия негативных факторов внешней среды. «Обеспечение комплексной устойчивостью сортов и гибридов к действию биотических и абиотических стрессов должно быть главной целью интегрированных селкционно-агротехнических программ» (Жученко, 2001).
К сожалению, запаса генетического материала самой мягкой пшеницы недостаточно для решения этой проблемы (Feldman, 1983; Sears, 1972; Hope et al., 1984). Более того, ее генофонд был в значительной степени обеднен из-за широкого распространения однотипных сортов с перекрывающимися родословными. В особенности это касается генов устойчивости к болезням, ограничение разнообразия которых является одним из основных лимитирующих факторов селекции (Давоян,2006).
В настоящее время при селекции растений на устойчивость к болезням используются методы гибридизации, мутагенеза и отбора. Селекционерами используются простые и сложные, внутривидовые, межвидовые, отдаленные скрещивания, химические и физические мутагены. Отборы устойчивых генотипов растений проводятся на фонах естественных и искусственных эпифитотий в обычных селекционных посевах и специальных полевых питомниках, в условиях закрытого грунта (теплицы, оранжереи, климатические камеры) и лаборатории(Гешеле, 1978).
Существует два типа устойчивости растений к паразитам: вертикальную и горизонтальную. Вертикальная устойчивость основана на точечном механизме защиты, когда растение прицельно разрушает тот или иной белок гриба-паразита. Эта защита получила название «ген-на-ген» (gene-for-gene), то есть против одного гена паразита работает один защитный ген хозяина.Такая защита обычно чрезвычайно эффективна, но недолговечна. На сегодняшний день известен ряд генов, принимающих участие в горизонтальной резистентности. Среди них гены Lr (leaf rust — листовая ржавчина), которые работают как у проростков, так и у взрослых растений(Van der Plank, 1966; 1972).
В процессе эволюции у растений и их паразитов выработались такие механизмы, которые обеспечивают сохранение генетического материала разнообразия обоих популяций (Генетические основы селекции….1973).
В последнее десятилетие получил развитее подход, объединяющий классическую селекцию и моелкулярно-генетические методы исследования - маркер-вспомогательная селекция (MAS, marker-assisted selection) которая используется в селекционных программах экономически развитых стран в качестве методического приема для интенсификации селекционных процессов (Varshney et al., 2005; Collard, Mackill, 2008). Большое число генов и локусов, контролирующих устойчивость различных видов злаков к биотическим и абиотическим стрессам, признаки урожайности и качества зерна, было идентифицировано и картировано с помощью ДНК-маркеров (Somers, 2004; Landjeva et al., 2007). Ряд селекционных схем, в которых были использованы маркеры, получил теоретическое и практическое обоснование.(Frich et al., 1999; Kuchel et al., 2007, 2008; Herzog, Frich, 2011)
Количественную, или горизонтальную, устойчивость обеспечивают также гены Yr (yellow rust — желтая ржавчина). Имеются работы по выяснению механизмов резистентности. Одна из них, выполненная учеными из США и Израиля под руководством Даолин Фу (Daolin Fu) и Хорхе Дубковски (Jorge Dubcovsky) с кафедры ботаники Калифорнийского университета в Дэвисе, дает информацию о работе гена из семейства Yr (A Kinase-START Gene…,2009). Другая, выполненная международной командой из Цюрихского университета (Швейцария), научно-промышленной исследовательской организации CSIRO Plant Industry (Канберра, Австралия) и Международного центра по разведению кукурузы и пшеницы (Мехико, Мексика), раскрывает механизм работы одного гена из семейства Lr (A Putative…,2009).
Количество эффективных Lr-генов устойчивости к возбудителю бурой листовой ржавчины с каждым годом сокращается (Бабаянц, 1990). Необходим постоянный поиск таких генов.
Считают, что в ряде случаев гену устойчивости растения может соответствовать несколько генов патогенности паразита (Щербаков, 1973). Возможна обратная ситуация, когда один ген патогенности соответствует нескольким генам устойчивости.
Х. Пирсоном был разработан метод идентификации генов устойчивости с помощью «тестирующих» рас патогенов с известной вирулентностью для различных схем хозяин-паразит (Person, 1969). Однако некоторые авторы (Одинцова, Михайлова, 1982) высказали целый ряд ограничений применения этого метода. Рядом исследователей было показано, что гены устойчивости могут быть тесно сцеплены, в т. ч. в сложных локусах (полигенный локус) или близко располагаться в хромосоме с другими генами (Рачинский, Донцев, 1969). При этом в блоки могут входить гены, контролирующие устойчивость к разным болезням. В результате мутации гена в блоке устойчивость к одним болезням может сцеплено наследоваться с восприимчивостью к другим (Щербаков, 1973).
В одинаковых локусах гомологичных хромосом может наблюдаться локализация как одних и тех же генов, так и аллельных, определяющих их различное состояние. Предполагают, что эволюция генов устойчивости растений к болезням происходит постепенно или неожиданно в результате эффекта транслокации (Щербаков, 1970).
При селекции многобарьерных и конвергентных сортов, обладающих различными типами устойчивости, действие малых генов может быть маскировано действием больших генов устойчивости. В этом случае необходимо иметь вирулентные к большим генам расы-биотипы-патотипы, на фоне которых можно выявить действие других генов. Если таких патотипов не имеется, то в процессе селекции можно потерять устойчивость, обусловленную малыми генами. Этот случай был назван Ван дер Планком (1966) «эффектом Вертифолии». Аналогичная необходимость в вирулентных к различным генам устойчивости «тестирующих» расах возникает при конвергентной селекции. При отсутствии таковых можно использовать различные маркеры генов устойчивости (Попереля, Бабаянц, 1978).
Одним из наиболее удобных, быстрых и результативных типов исследований является полимеразная цепная реакция, открытая Кэрри Мюллисом в 1983 году. Она позволяет получить миллионы копий (амплифицировать) интересующего участка ДНК.
Для того, чтобы прошла амплификация, необходимо двухцепочечную ДНК разделить на 2 комплементарных нити. Это достигается путём нагрева до 93-95ºС градусов. Далее необходимо ‹‹присоединить›› праймеры к комплементарным участкам. Для этого нужно снизить температуру до такого уровня, при котором праймер сможет ‹‹прикрепиться›› к комплементарному участку. Такая температура называется температурой ‹‹отжига››, её можно рассчитать по формуле:
t = (A+T)x2 + (G+C)x4 – 5C
После того, как праймер прикрепился к нужному участку, ставится оптимальная температура для работы Taq-полимеразы. Она равна 72 градусам. Следующим шагом будет повторная денатурация ДНК при 93-95 градусах. Допустим, у нас была изначально всего одна ДНК, если мы проведем 35 вышеописанных циклов, мы получим: 1х234=17179869184 копии.
ДНК-ма́ркеры (ДНК-маркёры) или молекулярно-генетические маркеры, полиморфный признак, выявляемый методами молекулярной биологии на уровне нуклеотидной последовательности ДНК, для определенного гена или для любого другого участка хромосомы при сравнении различных генотипов, особей, пород, сортов, линий.
Селекция с помощью маркеров облегчает отбор устойчивых сортов, основываясь на тесной связи между маркерными аллелями и геном, отвечающим за качественные или количественные признаки, благодаря точной передаче участков хромосомы, несущий интересующий ген (Singh R.P. et al.,2004). По данным исследования CiMMyt (international Maize and Wheat improvement Center), сочетание 4-5 генов устойчивости приводит к высокому уровню вирулентности, равной с иммунностью(Edwards K. et al,1991). Это так же было подтверждено в работе описывающей пирамидирование 5 генов и 2 локусов количественных признаков устойчивости к болезням (Lr19, Lr34, Sr2, Sr26, YrSp, QYr, sgi-7D и QYr.sgi-2B (D.G. Bonnet et al., 2005).
Имеется целый набор современных технологий выявления полиморфизма на уровне ДНК, среди которых можно выделить следующие:
анализ полиморфизма длин рестриктных фрагментов ДНК (RFLP);
анализ полиморфизма с помощью полимеразной цепной реакции (ПЦР).
Метод полимеразной цепной реакции (ПЦР) предполагает использование специфических праймеров и получение дискретных ДНК-
выявлять маркеры с кодоминантным наследованием и, соответственно, удобен для выявления гетерозигот по данному локусу. Однако, одна пара праймеров для флангов в ПЦР позволяет рассматривать полиморфизм только одного локуса. Для многих микросателлитных локусов не удается выявить полиморфизм. Как правило, фланкирующие последовательности для данного микросателлитного локуса оказываются видоспецифичными.
2.Материалы и методы
Работа была проведена на базе лаборатории иммунитета зерновых культур к грибным болезням ГНУ ВНИИ БЗР.
2.1.Объект исследований
Объектами исследований служили ДНК 40 сортов мягкой пшеницы.
2.2.Растворы и буферы
TBE - Tris/Borate/EDTA - Трис(гидроксиметил)аминометана / Соли борной кислоты/ Этилендиаминтетрауксусная кислота
CTAB - ЦТАБ - Цетилтриметиламмоний бромид
dd Н2О – дважды дистиллированая очищенная вода
Термостабильная ДНК-полимераза – Thermus aquaticus (Taq-полимераза), Pirococcus furiosus (Pfu-полимераза)
DNTP mix - Дезоксирибонуклеозидфосфаты (dATP, dGTP, dCTP, dTTP).
10x buffer – р-р сульфатов и бычий сывороточный альбумин.
Краситель – динитрофенол
Все реактивы приготовлены фирмой «SibEnzyme».
2.3.Выделение и подготовка ДНК к анализу
2.3.1.Экстракция тотальной растительной ДНК
ДНК выделяли из листьев 7-дневных проростков микрометодом, как предложено Edwards et al. в модификации Дорохова и Клоке(Дорохов Д.Б.. Клоке Э, 1997).
Концентрация ДНК в рабочем растворе составляла 50-60 нг/мкл.
Экстракция тотальной растительной ДНК происходит в три этапа:
I – Гомогенизация. Самый важный этап, т.к. от него в большей степени зависит общая чистота и легкость получения конечного продукта экстракции. При гомогенизации получается однородная растительная масса.
II – Депротеинизация. Очищение ДНК от белковых компонентов.
III – Осаждение ДНК.
Используем наиболее свежие и молодые образцы пшеницы. (верхушечные листья, которые только начинают расти) с избытком меристематической ткани, т.к. они лучше поддаются гомогенизации и в них соответственно больше ДНК.
I – Механически гомогенизируем растительный материал пестиком в пробирке типа ЭППЕНДОРФ объемом 1,5 мл, добавляем 200 мкл 2%-го р-ра СТАВ, предварительно разогретого до 65Сº, добавляем к полученному гомогенату 250 мкл 2%-го СТАВ и 450 мкл ddН2О,после чего пробирки с гомогенатом встряхиваем 10 мин при 200 об\мин.
II –. Депротеинизация ДНК
Выдерживаем пробирки с гомогенатами образцов 2 часа в термостате при температуре 65 градусов, добавляем депротеинизирующий раствор (хлороформ) 576 мкл к содержимому пробирок (разогретый гомогенат) и помещаем пробирки на стряхиватель 15 мин при 200 об\мин. После этого центрифугируем их 15 мин при 13.400 об\мин. Отбираем супернатант каждого образца и помещаем его в стерильную пробирку. Полученный в процессе центрифугирования осадок сбрасывается. Добавляем 200 мкл изопропанола к разлитым в новые пробирки супернатантам и помещаем на встряхиватель на 15 мин при 200 об\мин. После этого центрифугируем 15 мин при 13.400 об. в мин.
Затем изопропанол сливается из пробирок(на дне должен остаться белесый осадок)
III – Осаждение ДНК.
Добавляем 10 мкл 70%-ного этанола в каждую пробирку с депротеинизированой ДНК, центрифугируем пробирки 5 мин при 13.400 об. в мин. После добавляем 100 мкл 96%-ного этанола в каждую пробиркуи повторно центрифугируем 5 мин при 13.400 об. в мин. Затем сливаем этанол из пробирок(на дне остается белесый осадок) и добавляем в каждую пробирку 100 мкл dd Н2О стерильной для разведения ДНК.
2.4.Полимеразная цепная реакция.
Для проведения ПЦР требуются следующие компоненты:
•ДНК-матрица
•Два праймера, комплементарные противоположным концам требуемого фрагмента ДНК.
•Термостабильная ДНК-полимераза – фермент, который катализирует реакцию полимеризации ДНК– Thermus aquaticus (Taq-полимераза), Pirococcus furiosus (Pfu-полимераза),.
•Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
•Ионы Mg2+, необходимые для работы полимеразы.
•10x buffer - обеспечивающий необходимые условия реакции – pH, ионную силу раствора. Содержит сульфаты, бычий сывороточный альбумин.
Проведение ПЦР осуществляли на амплификаторе Eppendorf Mastercycler gradient.
2.5. Электрофорез
Электрофорезом называется разделение чего либо электрическим током, может использоваться для того, чтобы визуализировать результаты проведенной реакции. Электрофорез проводят в геле, он может быть агарозным, или акриламидным. Гель делают на основе раствора электролитов (солей и кислот), как правило это трис-HCL, борная кислота и ЭДТА (TBE). Так как молекулы ДНК заряжены отрицательно, они начинают двигаться в сторону катода. Но, гель представляет для молекул довольно мощную преграду, чем они крупнее по своему размеру, тем труднее им проходить через слой молекул геля. Таким образом, более мелкие молекулы (50 bp) за час электрофореза успевают пройти несколько сантиметров, а более крупные (1000 bp), проходят пару сантиметров. Чтобы наблюдать ДНК, используют бромистый этидий или импрегнируют серебром.
Электрофорез амплификантов ДНК вели в течение 1,5 ч. в 1,5 % агарозном геле, с использованием 0,5x TBE. Напряжение составляло 4В на 1 см камеры. Электрофорез проводили в агарозном геле в горизонтальной камере фирмы «Amersham Biosciences».
Для того чтобы найти нужный нам ген в гель вводят маркер. Маркер - линейные фрагменты ДНК известной длины (ДНК «линейка»)
У разных маркеров эта «длина» различается. Наиболее распространен в исследованиях маркер начинающийся с отметки в 50 пар нуклеотидов. Расчет по нему идет снизу на верх, нижняя черта это 50 пар, следующая 100 пар, затем 150 пар, после 200 пар, затем 300 пар и т.д. На изображении с готового электрофореза (электрофореграмме) проводится горизонтальная линия, отмеряемая по маркерной «линейке» на высоте совпадающей с весом исследуемого гена. И, соответственно те участки ДНК что оказываются выпавшими на этом уровне означают, что в данном образце наличествует искомый ген. Молекулярную массу фрагментов оценивали с помощью маркера 50 bp DNA-labber (Fermentas лит.) для агарозного геля. Затем электрофореграммы фотографировали, и полученные изображения обрабатывали на компьютере в программе FSViever.
3.Молекулярно-генетические методы для выявления генов устойчивости пшеницы к возбудителям ржавчины
В данной исследовательской работе использовались сорта мягкой пшеницы,проводилось выявление генов устойчивости к различным болезням, это бурой (Puccinia triticina Rob.ex Desm. f.sp. tritici Erikss. et Henn .) (Lr – leaf rust) Lr гены устойчивости – Lr19, желтой ржавчины (Puccinia striiformis West. f.sp. tritici Erikss. еt Henn.) (Yr – yellow rust) Yr гены устойчивости – Yr17, Yr 24,стеблевой ржавчины (Puccinia graminis Pers. f.sp. tritici Erikss. еt Henn.) (Sr - stem rust) Sr гены устойчивости – SR9a, Sr31, Sr32, Sr33.
Было исследовано порядка 40 сортов, на устойчивость к разным типам ржавчины.
Использовалась унифицированная схема для создания master mix и программ амплификации:

Соответственно формула расчета квоты р-ра на одну пробирку для каждого праймера была -
Nмкл=25мкл-(Xмкл+Yмкл)
Значения для X,Y,n и t-T брались из описания праймера.Были проведены исследования на гены Sr9a, Sr31, Sr32, Sr33, Yr24, Yr17, Lr 19.
ПЦР с праймером Sr 9a. Исследовалось 37 образцов ДНК +К +Кч
Мастер miх на 40 пробирок:

Объем мастер микс на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл\
Электрофорез:
1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 К М Кч 
Рис. 1. Электрофореграмма Ген Sr 9a, условия эксперимента - (85 мл ТБЕ+1,2г агара), 20 слот гель, В-105, А-120, Т-110 мин, ПЦР продукта по 12 мкл, М 2,5 мкл, красителя по 5 мк. Схема – 1-18 К М Кч
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
19 20 21 23 24 27 28 29 30 31 32 33 34 35 36 37 38 39 М

Рис. 2. Электрофореграмма Ген Sr 9a, условия эксперимента - (85 мл ТБЕ+1,2г агара), 20 слот, В-105, А-120, Т-120 мин, ПЦР продукта по 12 мкл, М 2,5 мкл, красителя по 5 мк. Схема – 18-37 М Кч
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген находится в сортах номер – 1, 3, 6, 17, 19, 20, 24, 27, 31, 32, 34, 37, поскольку линия выпадания данного гена будет находится на прямой линии проложенной между третьей и четвертой отметкой маркера в агарозном геле.
ПЦР с праймером Sr 31. Исследовалось 36 образцов ДНК +К+К+Кч
40 –для Sr 31 41 –контроль на ген
| master mix(х20) | программа режим амплификации | ||||||||||||
| SR 31 | 1200 bp | ||||||||||||
| Н2О | 17.87 | 671,2/684,9 | 94⁰ - 3' | ||||||||||
| Праймер F | 0,64/ 0,54 | 25,6/ 21,8 | 94⁰ - 1' | ˥ | |||||||||
| праймер R | 0,8/ 0,63 | 35,2/ 25,3 | 55⁰ - 1' | } | X45 | ||||||||
| 10x bufer | 2,5 | 72⁰ - 2' | ˩ | ||||||||||
| MgCl2 | 1,5 | 72⁰ - 10' | |||||||||||
| dntp mix | 0,5 | hold - 4⁰ | |||||||||||
| Taq pol | 0,2 | ||||||||||||
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
Электрофорез:
1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 М Кс К н
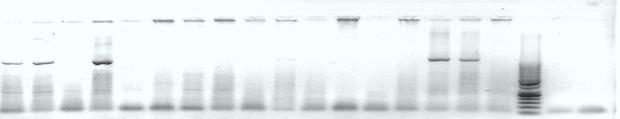
Рис. 3. Электрофореграмма Ген Sr 31, условия эксперимента - (85 мл ТБЕ+1,2г агара+3мкл бр эт), (1200 bp), 20 слот, В-105, А-120, Т-1.15, ПЦР продукта по 12 мкл, М (50 п.н.) по 3,5 мкл, красителя по 5 мкл. Схема- 1-17, Кс, Кн
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
19 20 21 23 24 25 26 27 28 29 М 30 31 32 33 34 35 37 38 41

Рис. 4. Электрофореграмма Ген Sr 31, условия эксперимента - (85 мл ТБЕ+1,2г агара+3мкл бр эт), (1200 bp), 20 слот, В-105, А-120, Т-1.15, ПЦР продукта по 12 мкл, М (50 п.н.) по 3,5 мкл, красителя по 5 мкл. Схема- 18-27, М 28-36 Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген находится в сортах номер – 1, 3, 5, 16, 17, 23, 25, 29, 30, 31, 32, 37, поскольку линия выпадания данного гена будет находится на прямой линии проложенной с двенадцатой отметкой маркера в агарозном геле.
ПЦР с праймером Sr 32Исследовались 32 образца ДНК +Кч
| master mix(х20) | программа режим амплификации | |||||||
| SR 32 | 900 bp | |||||||
| Н2О | 17.87 | 598,7 | 94⁰ - 3' | |||||
| Праймер F | 0,54 | 18.9 | 94⁰ - 1' | ˥ | ||||
| праймер R | 0,63 | 22,05 | 55⁰ - 1' | } | X45 | |||
| 10x bufer | 2,5 | 87,5 | 72⁰ - 2' | ˩ | ||||
| MgCl2 | 1,5 | 52,5 | 72⁰ - 10' | |||||
| dntp mix | 0,5 | 17,5 | hold - 4⁰ | |||||
| Taq pol | 0,2 | |||||||
| ДНК |
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
Электрофорез
М 1 3 4 5 6 7 8 9 10 11 12 13 14 14 15 16 17 18 Кч

Рис. 5. Электрофореграмма: Ген Sr 32, условия эксперимента - (85 мл ТБЕ+1,2г агара+3мкл бр эт), (900 bp), 20 слот, В-108, А-120, Т-1.25; ПЦР продукта по13мкл, М (100пн +50пн) -1,8 мкл, Схема М с 1по 17, Кч
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
М 19 20 21 23 24 25 26 27 28 29 30 31 32 35 41 1 2 3 4

Рис. 6. Электрофореграмма Ген Sr 32, условия эксперимента - (85 мл ТБЕ+1,2г агара+3мкл бр эт), (900 bp), 20 слот, В-108, А-120, Т-1.25; ПЦР продукта по13мкл, М (100пн +50пн) -1,8 мкл, Схема М с 18по 32 (Sr 32), 1-4 (Yr 24)
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген отсутствует, поскольку линия выпадания данного гена будет находится на прямой линии проложенной с седьмой отметкой маркера в агарозном геле.
ПЦР с праймером Sr 33 Исследовалось 37 образцов ДНК + К + Кч
| master mix(х20) | программа режим амплификации | |||||||
| SR 33 | 197 bp | |||||||
| Н2О | 17.79 | 355,8 | 711,6 | 94⁰ - 3' | ||||
| Праймер F | 0,22 | 4,4 | 8,8 | 94⁰ - 1' | ˥ | |||
| праймер R | 0,29 | 5,8 | 11,6 | 59⁰ - 1' | } | X45 | ||
| 10x bufer | 2,5 | 72⁰ - 2' | ˩ | |||||
| MgCl2 | 1,5 | 72⁰ - 10' | ||||||
| dntp mix | 0,5 | hold - 4⁰ | ||||||
| Taq pol | 0,2 | |||||||
| ДНК |
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
Электрофорез:
1 3 4 5 6 7 8 9 10 11 М К 12 13 14 15 16 17 18 19

Рис. 7. Электрофореграмма Ген Sr 33, условия эксперимента - (85 мл ТБЕ+1,2г агара), 20 слот В-105, А-120, Т-110 мин, ПЦР продукта по 12 мкл, М 2,5 мкл, красителя по 5 мк. Схема- 1-10, М, К, 11 - 18
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
20 21 23 24 25 26 27 28 29 М К 30 31 32 33 34 35 36 38 39

Рис. 8. Электрофореграмма Ген Sr 33, условия эксперимента - (85 мл ТБЕ+1,2г агара), 20 слот В-105, А-120, Т-110 мин, ПЦР продукта по 12 мкл, М 2,5 мкл, красителя по 5 мк Схема- 19-27, М, К, 28 – 35
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген находится в сортах номер – 3, 6, 10, 25, 28, 31,, поскольку линия выпадания данного гена будет находится на прямой линии проложенной с четвертой отметкой маркера в агарозном геле.
ПЦР с праймером Yr 24 Исследовалось 32 образца ДНК + К + Кч,
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
| master mix(х20) | программа режим амплификации | |||||||
| YR 24 | 258 bp | |||||||
| Н2О | 585.1 | 94⁰ - 3' | ||||||
| Праймер F | 0.93 | 32.7 | 94⁰ - 1' | ˥ | ||||
| праймер R | 0.62 | 21.7 | 55⁰ - 1' | } | X45 | |||
| 10x bufer | 2,5 | 87,5 | 72⁰ - 2' | ˩ | ||||
| MgCl2 | 1,5 | 52,5 | 72⁰ - 10' | |||||
| dntp mix | 0,5 | 17,5 | hold - 4⁰ | |||||
| Taq pol | 0,2 | |||||||
| ДНК |
Электрофорез:
М 1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 кч
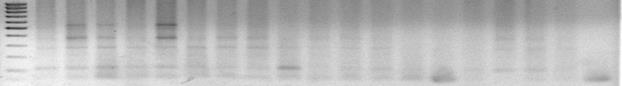
Рис. 9. Электрофореграмма Ген Yr 24, (85 мл ТБЕ+1,2г агара), (258 bp), 20 слот, В-108, А-120, Т-1.25; ПЦР продукта по13мкл, М (100пн +50пн) -1,8 мкл, Схема М с 1по 17, кч
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
М 20 21 23 24 25 26 27 28 29 30 31 32 35 41

Рис. 10. Электрофореграмма Ген Yr 24, (85 мл ТБЕ+1,2г агара+3мкл бр эт), 20 слот, В-108, А-120, Т-1.25; ПЦР продукта по13мкл, М -1,8 мкл, Схема М с 19 по 32,
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 300 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген находится в сортах номер – 3, 4, 6, 25, 28 поскольку линия выпадания данного гена будет находится на прямой линии проложенной на пару миллиметров ниже пятой отметки маркера в агарозном геле.
ПЦР с праймером Yr 17 Исследовалось 34 образца ДНК +К+ К +Кч,
| master mix(х20) | программа режим амплификации | |||||||
| Yr 17 | 259 bp | |||||||
| Н2О | 587,6 | 94⁰ - 3' | ||||||
| Праймер F | 32,1 | 94⁰ - 1' | ˥ | |||||
| праймер R | 19,8 | 60⁰ - 1' | } | X40 | ||||
| 10x bufer | 2,5 | 87,5 | 72⁰ - 2' | ˩ | ||||
| MgCl2 | 1,5 | 52,5 | 72⁰ - 10' | |||||
| dntp mix | 0,5 | 17,5 | hold - 4⁰ | |||||
| Taq pol | 0,2 | |||||||
| ДНК |
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
Электрофорез:
М 1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20

Рис. 11. Электрофореграмма: Ген Yr 17, (85 мл ТБЕ+1,2г агара) условия эксперимента - 20 слот, В-110, А-120, Т-1.15, ПЦР продукта по 13 мкл, М(50 п.н.) по 1,5 мкл, красителя по 3 мкл. Схема - М - 1-19, №8 и 10 только по 5мкл
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 250 и.т.д. пар нуклеотидов
М50 18 19 20 21 23 24 25 26 27 28 29 30 31 32 35 41 Кгс Кгн

Рис. 12. Электрофореграмма Yr 17, (85 мл ТБЕ+1,2г агара), условия эксперимента -
20 слот, В-105, А-120, Т-1.30, ПЦР продукта по 13 мкл, М (50 п.н.) по 1,5 мкл, красителя по 3 мкл. Схема - М (50 пн) – 2,5 мкл; 17 32,31
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 250 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген отсутствует поскольку линия выпадания данного гена будет находится на прямой линии проложенной на пятой отметки маркера в агарозном геле.
ПЦР с праймером Lr 19, исследовалось 34 образца ДНК К +Кч
Объем мастер мих на 1 образец = 23 мкл + 2 мкл ДНК =25 мкл
| master mix(х20) | программа режим амплификации | |||||||
| LR 19 | 130 bp | |||||||
| Н2О | 94⁰ - 3' | |||||||
| Праймер F | 0.3 | 10.9 | 94⁰ - 1' | ˥ | ||||
| праймер R | 0.6 | 21.6 | 60⁰ - 1' | } | X40 | |||
| 10x bufer | 2,5 | 87,5 | 72⁰ - 2' | ˩ | ||||
| MgCl2 | 1,5 | 52,5 | 72⁰ - 10' | |||||
| dntp mix | 0,5 | 17,5 | hold - 4⁰ | |||||
| Taq pol | 0,2 | |||||||
| ДНК |
Электрофорез
М50 1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Кг

Рис. 13. Электрофореграмма: Lr 19 (85 мл ТБЕ+1,2г агара+3мкл бр эт), 20 слот, В-108, А-120, Т-1.25 ПЦР продукта по 13 мкл, М (100 пн + 50 п.н.) по 1,8 мкл, красителя по 3 мкл. Схема - М - 1-18, 33
Примечания - цифрами сверху указаны номера исследуемых ДНК. Маркерный расчет (по линиям снизу на верх) – 50, 10, 150, 200, 250 и.т.д. пар нуклеотидов
Таким образом мы видим что искомый ген отсутствует поскольку линия выпадания данного гена будет находится на прямой линии проложенной между
третьей и четвертой отметкой маркера в агарозном геле.
4. Заключение
Данным методом, в течении двух рабочих дней, удалось определить какие сорта стоит использовать в дальнейшем для каждого гена, что является неоспоримо выгодным перед классическим методом аппробации через выращивание.
В ходе проведенных исследований были получены следующие результаты –
1. Сорта обладающие четырьмя различными генами резистентности - №3 и №6, что позволяет рекомендовать их как наиболее устойчивые к фитопатогенам.*
2. Сорта обладающие тремя генами резистентности – №25 и № 31,что позволяет рекомендовать их как приемлемо устойчивые к фитопатогенам.*
3. Сорта обладающие минимальным комплексом генов резистентности – №1, №17, №28, №32 и № 37, что характеризует их как слабо устойчивые к фитопатогенам.*
4. оставшиеся сорта - №2,№4,№5,№7-16,№18-27,№29,№30,№33-36,№38-42 как не резистентные.*
*Примечание – в рамках проведенного объема исследований.
5. Список использованных источников.
1.Бабаянц Л.Т. Генетика устойчивости пшеницы к основным болезням // Проблемы повышения устойчивости зерновых культур и подсолнечника к болезням и вредителям // Сборник научных трудов ВСГИ, 1990. С. 5 - 15.
2.Бабаянц Л.Т., Мештерхази А., Вехтер Ф., и др. //Методы селекции оценки устойчивости пшеницы и ячменя к болезням в странах-членах СЭВ// Прага. 1988. С.125 - 169
3.Вавилов Н.И. Иммунитет растений к инфекционным заболеваниям // М: Наука, 1986.
4.Ван Дер Планк. Устойчивость растений к болезням // Колос, 1972. 154.с
5. Генетические основы селекции растений на иммунитет //Будашкина Е.Б., Дьяков Ю.Т., Жуковский П.М. и др. // М: Наука, 1973. С.120 – 134
6.Гешеле Э.Э. Основы фитопатологической оценки в селекции растений // Колос, 1978.
7.Гультяева Е.И. Молекулярные подходы в идентификации генов устойчивости к бурой ржавчине у российских сортов пшеницы // Доклады Российской академии сельскохозяйственных наук. 2009. №5. С. 23-26.
8.Давоян Р.О. Использование генофонда дикорастущих сородичей в улучшении мягкой пшеницы (Triticum aestivum L.) // Краснодар, 2006 – 160с
9.Дорохов Д.Б.. Клоке Э. Быстрая и экономичная технология RAPD анализа растительных геномов // Генетика. 1997. Т. 33. С.443–450.
10.Жученко А.А. Адаптивная система селекции растений (эколого-генетические аспекты) // монография в двух томах. М.: Изд-во РУДН. 2001. Том II. -708с.
11.Кривченко В.И. Селекция растений на устойчивость к болезням и проблема доноров. // Тез. докл. 9 конгр. ЕУКАРПИА. 1981. С.85-87.
12.Кудинова О.А. Взаимосвязь вирулентности RAPD-полиморфизма северо-кавказской популяции возбудителя бурой ржавчины пшеницы: автореф. дис. … канд. биол. наук: 06.01.07 // ГНУ ВНИИБЗР РАСХН. Краснодар, 2012. 24с.
13.Курбанова П.М. Генетическое разнообразие яровой мягкой пшеницы по эффективной возрастной устойчивости к листовой ржавчине: автореф. дис. … канд. биол. наук: 03.02.07 // ВНИИР. СПб, 2011. 20с.
14.Одинцова И.Г., Михайлова Л.А. Ограничения для применения метода идентификации генов устойчивости к болезням с помощью клонов фитопатогенов с известной вирулентностью // Труды по прикладной ботанике, генетике и селекции ВНИИ растениеводства. 1982. Т.71 С. 35 – 40.
15.Попереля Ф.А., Бабаянц Л.Т. Блок компонентов глиадина IB3 как маркер гена, обусловливающего устойчивость растений пшеницы к стеблевой ржавчине // Докл. ВАСХНИЛ. 1978. С. 6 – 8.
16.Рачинский Т, Донцев Н. Унаследявана устойчивоста на пшеницата сорт №234 към физиологическите раси 13, 21, 55, 77, 11, 122 на кафявата ръжда // Проблемы селекции. – София, 1969. С. 237 – 242.
17.Щербаков В.К. Генетика, селекция, интродукция и защита сельскохозяйственных растений// В сб. Итоги науки. Биологические основы растениеводства //. Докл. ВИНИТИ. 1970. С.111.
18.Щербаков В.К. Использование индуцированного иммунитета в селекции растений.// М., 1973
19. A Kinase-START Gene Confers Temperature-Dependent Resistance to Wheat Stripe Rust. Daolin Fu [et al] // Science. 6 March 2009. V. 323. P. 1357–1360.
20.A Putative ABC Transporter Confers Durable Resistance to Multiple Fungal Pathogens in Wheat//Simon G. [et al]// Science.6 March 2009.V. 323. P. 1360–1363.
21.Collard B.C.Y., Mackill D.J. Marker assisted selection: an approach for precision plant breeding in the twenty-first century // Phios. Trans. R. Soc. B. 2008. V. 363. P. 557-572.
22.Edwards K., Jonstone C., Thompson C.A. Simple and rspid method for the preparation of plant genomic DNA for PCR analysis //Nucl. Acids Res. 1991. V. 19. P. 1349
23.Feldman M., I. Strauss A genome restructuring gene in Aegilops longissima. // Proc. 6th Int. Wheat Genet. Sympos. Kyoto, Japan. 1983. P. 309-314.
24.Frisch M., Melchinger A.E. Comparison of selection strategies for market assisted backcrossing of a gene // Crop Sci. 1999. V. 39. P. 1295-1301.
25.Frisch M., Melchinger A.E. Selection theory for market-assisted backcrossing // Genetics. 2005. V. 170. P. 909-917.
26.Herzog E., Frisch M. Selection strategies for market-assisted backcrossing with high-throughput marker systems // Theor. Appl. Genet. 2011. V. 1233. P. 251-260.
27.Hope H.J., A.Comea, P. Hasty Ice encasement tolerance of prairienland ryegrass, orbit tall wheatgrass and puma rye grown under controlled environments. // Cereal Res. Communic. Szegtd. 1984. V. 12. P. 101-103
28.Kuchel H., Fox R., Reiinheimer J. Et al. The successful of application of a market-assisted wheat breeding strategy// Mol. Breed. 2007. V. 20. P. 295-308.
29.Kuchel H., Fox R., Hollemby G.et al. The challenges of integrating new technologies into a wheat breeding programme. // 2008. http:// ses.library.usyd.edu.au/bitstream/2123/3400/1/O54.pdf.
30.Landjeva S., Korzun V., Borner A. Molecular markers: actual and potencial contributions to wheat genome characterization and breeding // Euphitica. 2007. V. 156. P. 271-296.
31.McIntosh R.A., Dyck P.L. and Green G.J. Inheritance of leaf rust and stem rust resistances in wheat cultivars Agent and Agatha \\ Australian Journal of Agricultural Research. 1976. V. 28. P. 37 – 45.
32.McIntosh R.A., Hart G.E. and Gale M.D. Catalogue of gene symbols for wheat // Wheat Information Service. 1989. V. 69. P. 49 – 63.
33.McIntosh R.A., Wellings C.R., Park R.F. Wheat rust: An atlas of Resistance Genes.// Dordrecht: Kluwer Acad. Publ., 1995.
34.Person C. Gene-for-gene relationship in host parasite systems // Can. J. Bot.1969. P. 1101 – 1130.
35.Sears E.R. Chromosome engineering in wheat. // Stadler Symp., Univ. of Missoure, Columbia, USA. 1972. V.4. Р. 23-28.
36.Singh R.P., William H.M., Huerta-Espino J., Rosewarne G. Wheat rust in asia: meeting the challenges with old and new technologies. //“New directions for a diverse planet”.// Proceedings of the 4th international Crop science Congress, 26 Sep – 1 Oct. Brisbane, Australia. https:\\www.cropscience.org.au. – 2004.
37.Somers D.J. Eds P.K. Gupta, R.K. Varshney Molecular marker systems and their evaluation for cereal genetics // Cereal Genomics // Netherlands: Kluwer Acad. Publ., 2004.
38.Van der Plank J.E. Horizontal (polygenic) and vertical (olygogenic) resistance against blight. //American Potato. 1966. V.43. №2. P.43-52.
39.Varshney R.K., Graner A., Sorrells M.E. Genovics-assisted breeding for crop improvement // Trends Plant Sci. 2005. V. 10. P. 621-630
40.Volkova G. Population structure of wheat disease pathogens causing epiphitotics in Southern Russia // Proc. of Oral Papers and Posters, Technical Workshop, BGRI, Cd. Obregon, Sonora, Mexico. 2009. P.230
Дата добавления: 2015-09-12; просмотров: 51 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Nijimura Shuuzo | | | Введение |