
КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА
ВСЕУКРАЇНСЬКА СТУДЕНТСЬКА ОЛІМПІАДА З ХІМІЇ. І ЕТАП
КИЇВ, 2015
1. Імпедиметрія. Імпедиметричний аналіз, що базується на електрохімічній імпедансній спектрометрії (ЕІС), є надзвичайно чутливим та селективним методом і тому останнім часом привертає значну увагу. Основою ЕІС є вимірювання імпедансу – фізичної величини, яка описує опір електричного ланцюга по відношенню до змінного електричного струму. Ця комплексна величина визначається наступним рівнянням:

де Z – імпеданс; Zre та iZ im – його дійсна та уявна частини; U – напруга; I – струм; w – частота струму; j – зсув фази струму по відношенню до фази напруги.
Для найпростіших елементів електричного ланцюга імпеданс має вигляд: опір – Z = R, ємність – Z = (iwC) –1, індуктивність – Z = iwL. У випадку неідеальних ємностей Z = (iw) – nC –1, де n – деякий коефіцієнт, 0< n <1. Для послідовно з’єднаних елементів виконується рівняння Z = Z1 + Z2 + … + Zn; для паралельно з’єднаних – 1/ Z = 1/ Z1 + 1/ Z2 + … + 1/ Zn.
Поширеним варіантом представлення результатів вимірювання імпедансу в ЕІС є так звана діаграма Найквіста – у даному випадку це залежність Zim від Zre.
Нещодавно було розроблено систему для імпедиметричного визначення хрому (VI), що являє собою золотий електрод, вкритий моношаром похідної 1-аза-18-крауну-6 та вміщений у комірку, заповнену дегазованим розчином 5 мМ редокс-активних частинок (Fe(CN)63(4)–) та 0.1 М KCl, доведеним до pH = 5 за допомогою HCl. Модель, що описує дану систему, може бути представлена у вигляді наступного електричного ланцюга:
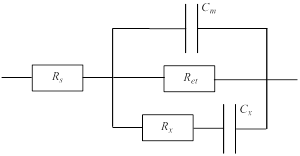
де Rs – опір розчину у комірці; Ret – опір, пов’язаний з переносом електронів між електродом та редокс-активними частинками ([Fe(CN)6]3(4)–); Сm – ємність, що виникає за рахунок моношару похідної 1-аза-18-крауну-6; Rx та Сx – опір та ємність, пов’язані з дефектами поверхні електроду та неідеальним нанесенням на нього моношару.
За рахунок утворення стійких сендвічевих комплексів 1-аза-18-крауну-6 з негативно зарядженими іонами HCrO4– відбувається блокування підходу до електроду редокс-активних частинок ([Fe(CN)6]3(4)–). Це призводить до зміни імпедансу, яка залежить від концентрації хрому (VI). На основі діаграм Найквіста, отриманих методом ЕІС розчинів з різним вмістом хрому (VI) (с, у мільярдних частках), було обчислено наступні значення параметрів вищезгаданого модельного електричного ланцюга:
| с, млрд.ч. | Rs, кОм | Ret, кОм | Cm, mФ×сn–1 | Rx, кОм | Cx, mФ×сn–1 | n |
| 205.1 | 0.7033 | 72.92 | 0.1671 | 0.8325 | ||
| 202.5 | 0.3711 | 58.26 | 0.305 | 0.8798 | ||
| 201.8 | 0.3176 | 66.68 | 0.297 | 0.8889 | ||
| 211.7 | 0.2950 | 79.71 | 0.2756 | 0.8922 | ||
| 203.4 | 0.2581 | 135.1 | 0.2743 | 0.9027 | ||
| 201.9 | 0.2461 | 314.0 | 0.2448 | 0.9037 | ||
| 207.6 | 0.2057 | 174.7 | 0.2225 | 0.8982 | ||
| 212.5 | 0.1586 | 136.8 | 0.2121 | 0.8986 | ||
| сx | 206.3 | 0.2753 | 180.3 | 0.2768 | 0.8954 |
1. Нехтуючи наявністю Rx та Cx та взявши n = 1, побудуйте діаграму Найквіста для описаної в умові системи за відсутності хрому (IV). Для цього в загальному вигляді виведіть рівняння для Zim та Zre, що включали б параметри Rs, Ret, Сm та w.
2. Який з параметрів електричного ланцюга слід використати для побудови калібрувальної кривої? Побудуйте цю криву, використавши логарифмічну шкалу для концентрації, вираженої у млрд. ч.
3. Чому побудована вами крива має дві лінійних ділянки?
4. За допомогою знайденої калібрувальної кривої встановіть значення концентрації сx.
2. Мт. 13:24–30. Розшифруйте синтез алкалоїду N (DMAP – 4-(диметиламіно)піридин):

3. ВМС та борани. Полімеризація нестійкої органічної речовини А (39.10% C, 8.75% H, 17.36% O та ще один елемент), ініційована боранами, є зручним методом одержання полімеру Б. Нещодавно розроблена методика одержання Б з високою молекулярною масою включає нагрівання розчину А (0.715 M, 12.2 мл) у декаліні, що містить комплекс BH3×Me3N (2.5 мг), при 95 °С протягом 30 хв з наступним охолодженням, додаванням дигідрату N‑ оксиду триметиламіну (2.9 мг) та додатковим витримуванням при 95 °С протягом ночі. Продукт реакції висаджують метанолом, що після серії промивань та висушування дає полімер Б з майже кількісним виходом (97%).
Для визначення молекулярної маси Б було використано метод гель-проникної хроматографії, яка розподіляє молекули за їх гідродинамічним об’ємом. Відомо, що гідродинамічний об’єм пропорційний добутку характеристичної в’язкості [ h ] та молекулярної маси М. В свою чергу, характеристична в’язкість визначається рівнянням Марка–Хаувінка:
[ h ] = K M a,
де K та a – деякі сталі для системи полімер – елюент за певної температури. Так, для полістирену за використаних умов K = 0.0146, a = 0.689; для Б K = 0.051, a = 0.725.
Зазвичай для визначення молекулярної маси певної фракції полімеру M за її об’ємом елюювання Ve проводять попереднє калібрування з використанням стандартних зразків, а вже за знайденою калібрувальною кривою за допомогою рівняння Марка–Хаувінка знаходять значення молекулярної маси досліджуваного зразка.
В обговорюваному експерименті в діапазоні молекулярних мас 103–105 калібрувальна крива на основі даних гель-проникної хроматографії стандартних зразків полістирену умов описувалася емпіричним рівнянням
lg M = 11.8 – 0.219 Ve (мл)
Хроматограма зразку Б, одержаного за описаною вище методикою, у табличному представленні мала вигляд:
| Ve , мл | 29.5 | 29.7 | 29.9 | 30.4 | |||||||
| I, мВ | –12.2 | –12.2 | –12.0 | –2.3 | 6.2 | 7.8 | 6.4 | –2.4 | –10.6 | –12.2 | –12.2 |
1. Встановіть А та Б, якщо молекулярна маса А менша за 100. Яку назву має Б?
2. Запропонуйте механізм утворення Б (підказка: це не радикальний процес).
3. Знахідкою авторів згаданої в умові методики є використання BH3×Me3N в якості ініціатора. Загальнодоступні комплекси борану (наприклад, BH3×Me2S) також здатні ініціювати полімеризацію А, однак їх використання призводить до утворення Б із суттєво нижчою молекулярною масою. Поясніть цей факт, якщо відомо, що ретельне видалення кисню дещо зменшує описаний ефект.
4. Яким є теоретичне значення молекулярної маси Б, виходячи із співвідношення вихідних речовин?
5. Детально опишіть, як за допомогою наведених в умові даних обчислити середньочисельну та середньомасову молекулярну масу зразку Б (Mn та Mw). Виконайте ці обчислення для однієї з цих величин (на Ваш вибір).
4. Політіонати. Вивчення кінетики взаємодії тетратіонату калію з сульфітом натрію у буферному розчині (рН = 4.7) методом HPLC дало змогу встановити наступні залежності концентрацій сульфурвмісних частинок від часу:
| t ×10–3, с | ||||||||
| [S4O62–], мМ | 5.00 | 3.91 | 3.16 | 2.27 | 1.80 | 1.44 | 1.25 | 1.07 |
| [S(IV)],* мМ | 5.00 | 3.78 | 3.16 | 2.27 | 1.75 | 1.45 | 1.26 | 1.08 |
| [S3O62–], мМ | 1.17 | 1.87 | 2.75 | 3.22 | 3.60 | 3.81 | 3.88 | |
| [S2O32–], мМ | 1.14 | 1.91 | 2.79 | 3.17 | 3.52 | 3.82 | 3.94 |
*[S(IV)] – загальна концентрація всіх частинок, що містять Сульфур(IV). pKa (HSO3–) = 7.2.
При вивченні ж аналогічної реакції тетратіонату калію з тіосульфатом натрію дані були наступними:
| t ×10–3, с | |||||||
| [S4O62–], мМ | 5.00 | 4.85 | 4.70 | 4.42 | 4.15 | 3.90 | 3.44 |
| [S2O32–], мМ | 5.00 | 5.00 | 4.92 | 4.91 | 4.92 | 5.04 | 5.01 |
| [S5O62–], мМ | 0.15 | 0.30 | 0.58 | 0.85 | 1.10 | 1.56 |
Додатково було встановлено концентрацію пентатіонат-йону через 2 год після початку реакції за різних початкових концентрацій реагентів:
| [S4O62–]0, мМ | 5.00 | 2.00 | 5.00 | 2.00 | 3.00 |
| [S2O32–]0, мМ | 5.00 | 5.00 | 2.00 | 2.00 | 3.00 |
| [S5O62–], мМ | 0.053 | 0.023 | 0.021 | 0.008 | 0.019 |
Цікаво, що пентатіонат-йон в невеликій концентрації також був присутній у розчині і під час реакції тетратіонату калію з сульфітом натрію.
1. Наведіть сумарні рівняння основних реакцій, що відбуваються в наведених системах.
2. Яким кінетичним рівнянням описується реакція тетратіонату калію з сульфітом натрію?
3. Встановіть кінетичне рівняння, що описує реакцію тетратіонату калію з тіосульфатом натрію на початкових етапах процесу.
4. Запропонуйте механізм реакції, що пояснював би усі наведені дані.
5. Знайдіть значення констант швидкості відповідних стадій (підказка: потрібно знайти три константи).
6. Як на швидкість реакції тетратіонату калію з сульфітом натрію впливатиме зміна рН у невеликих межах?
Пам’яті Брусиловця А. І. присвячується
5. Тонкий неорганічний синтез. Реакція бінарного броміду А з 1,2‑біс(дифенілфосфіно)етаном та циклогексеном призводить до утворення солі Б та рацемату органічної сполуки В у мольному співвідношенні 1:1. Реакція Б та (Ph2P)2NLi у мольному співвідношенні 1:1 дає цвіттеріонну сполуку Г, що не містить літію чи брому. Взаємодія Г з бінарними бромідами Д або Е, які утворені елементами однієї підгрупи періодичної системи в однакових ступенях окиснення, у мольному співвідношенні 1:1 дає Є та Ж, відповідно.
Вміст елементів (у % за масою): Б – 15.69% Br, 18.24% P; В – 29.79% C; 4.17% H; 66.05% Br; Є – 59.18% C, 4.14% H, 8.20% Br, 2.88% N, 19.08% P; Ж – 56.61% С, 3.96% H, 7.85% Br, 2.75% N, 18.25% P.
1. Встановіть А – Ж.
2. Зобразіть структуру всіх згаданих сполук молекулярної будови (включно з Є та Ж), а також катіону Б. Для фенільного замісника використовуйте позначення Ph.
Дата добавления: 2015-09-11; просмотров: 117 | Поможем написать вашу работу | Нарушение авторских прав |