
|
Читайте также: |
Первичной основой учения о химических превращениях веществ является стехиометрия, на которой базируются все количественные соотношения при химических реакциях.
Слово стехиометрия (от др.- греч. στοιχεῖον = «элемент» + μετρέω = «измерять») – буквально означает измерение элементов некоторого ряда или серии – раздел химии о соотношениях реагентов в химических реакциях. Обычно оно применяется ко всем способам вычислений, касающихся компонентов химической системы. Мы будем использовать его там, где приходится иметь дело со структурой арифметических соотношений между веществами, участвующими в химическом процессе. По существу, стехиометрия – это бухгалтерия материальных компонентов химической системы.
Изменения состава реагирующей смеси не случайны, а определяются двумя различными причинами. Первая причина — внешняя: подача или удаление вещества из системы; вторая причина — внутренняя: изменения, вызванные химической реакцией. В то время как перенос вещества в пространстве описывается уравнениями материального баланса, соответствующими определенному типу реактора, внутренние изменения зависят только от самой химической реакции и поэтому одинаковы для реакторов всех типов.
При химической реакции происходит количественное и качественное изменение состава участвующих в реакции молекул (разрушение исходных и образование новых) за счет перераспределения атомов, образующих молекулы реагентов. При этом атомы сохраняют свои индивидуальные свойства (например, масса, заряд ядра и т. п.) и образуют лишь вполне определенные связи между собой, определяющиеся структурой и зарядом их электронных оболочек. Иными словами, атомы образуют между собой лишь дискретные, целочисленные ассоциации (молекулы, радикалы, ионы) с учетом их валентных состояний.
С другой стороны, указанное постоянство атомов обеспечивает сохранение массы реагирующей системы. Эти очевидные и ставшие тривиальными положения, однако, чрезвычайно ценны для понимания динамики химических превращений. Учет этих связей особенно полезен при проведении кинетических исследований сложных реакционных систем.
Стехиометрия накладывает ограничения на возможные изменения состава реагирующей смеси.
В технике количество вещества чаще всего выражают через их массу mi, измеряемую в килограммах, тоннах и других единицах. В соответствии с «Законом эквивалентов», при химических реакциях вещества взаимодействуют в эквивалентных соотношениях. Однако, значения эквивалентов величины, строго говоря, не постоянные, и зависят от конкретной реакции, в которой это вещество участвует. Например, KMnO4 и K2SO3 в реакциях в разных средах реагируют различным образом:
- в кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
- в нейтральной среде: 2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
- в щелочной среде: 2KMnO4 + K2SO3 + 2KOH = 2 K2MnO4 + K2SO4 + H2O
Значение г-эквивалента KMnO4 в этих реакциях равно 31.6 г, 79.0 г и 158.0 г, соответственно.
Более удобны мольные количества. Напомним, что 1 г-моль любого вещества – содержит 6·1023 молекул (число Авогадро). При этом для выполнения закона эквивалентов, вводят стехиометрические коэффициенты.
В химии для материальных расчетов используют такие величины как моль или кмоль. Они связаны с массой соотношением
 или
или 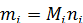 [2.1]
[2.1]
где Мi – молекулярная масса вещества (г/моль или кг/кмоль), ni – количество молей вещества.
Мольные количества вещества ni вполне подходят для характеристики периодических процессов. В условиях проточных процессов, когда вещества подают и выводят из реактора непрерывно, более приемлемой характеристикой является мольный поток, который для стационарного режима процесса выражается уравнением
 моль(кмоль)/в ед. времени[2.2]
моль(кмоль)/в ед. времени[2.2]
где t – промежуток времени, в течение которого подают ni моль вещества.
С точки зрения стехиометрии все химические реакции подразделяют на простые и сложные.
Простые реакции характеризуются тем, что при них протекает единственное необратимое превращение и не образуется иных стабильных продуктов, кроме записанных в уравнении реакции:
va A + vb B = vr R + vs S (I)
Для каждой простой реакции можно написать следующие равенства, являющиеся основным соотношением ее баланса:

 [2.3]
[2.3]
где vi – стехиометрический коэффициент вещества J. Эти равенства справедливы при условии, что стехиометрические коэффициенты расходуемых веществ берутся со знаком минус, а для образующихся – со знаком плюс. При этом величина n или F всегда положительна, инвариантна в отношении участников реакции и называется полнотой реакции.
Из равенств [2.3] вытекают уравнения материального баланса простых реакций
 [2.4]
[2.4]
по которым, зная начальные условия и n или F для одного из веществ, по формулам [2.3] находят полноту реакции и затем по уравнениям [2.4] мольные количества или мольные потоке всех других компонентов реакции.
Пример.
Полагая, что реакция диспропорционирования циклогексена с образованием бензола и циклогексана
3С6Н10 = 2С6Н12 + С6Н6
является простой, вычислить ni, если известно, что
 = 12 моль,
= 12 моль,  =
=  = 0 и
= 0 и  = 3 моль.
= 3 моль.
По уравнению [2.3] находим:

n = 3
Тогда по уравнению [2.4] имеем:
 = 0 + 2 · 3 = 6 моль
= 0 + 2 · 3 = 6 моль
 = 0 + 1 · 3 = 3 моль
= 0 + 1 · 3 = 3 моль
Из равенств [2.3] следует, что мольное соотношение образующихся или расходуемых веществ, при простых реакциях, постоянно и равно соотношению стехиометрических коэффициентов этих веществ в уравнении реакции:
ni - ni,0 = vi/vA· (nA – nA,0) или Fi - Fi,0 = vi/vA· (FA – FA,0)
В координатах Δni от ΔnA или ΔFi от ΔFA для любого компонента простой реакции должна получиться прямая, тангенс угла наклона которой равен vi/vA (рис. 2).
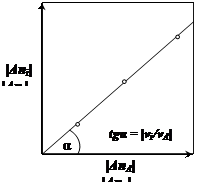
Рис. 2.2. Изменение мольного соотношения
веществ при простых реакциях
Этим путем можно экспериментально убедиться, что изучаемая реакция – простая.
Сложные реакции состоят из ряда простых реакций. К ним принадлежат:
- обратимые реакции
vA A + … ↔ vR R + …
- параллельные превращения
v1,A A + … → vR R + …
v2A A + … → vS S + …
- последовательные превращения,
vA A + … → vB B + … → vC C
а также более сложные в стехиометрическом отношении системы, включающие сочетания этих трех типов сложных реакций.
Среди веществ, участвующих в сложных реакциях, различают исходные реагенты и продукты. Среди исходных реагентов один – обычно основной (более дорогостоящий или определяющий основную схему превращений). В дальнейшем, будем обозначать его через А. Из продуктов реакции один является целевым, ради которого реализуется весь процесс. Целевой продукт обозначим буквой В. Остальные продукты реакции называют побочными. Соответственно этому реакция образования целевого продукта называется целевой, а остальные – побочными.
Необходимо отметить, что побочные продукты могут образовываться не только в побочных реакциях, но и быть продуктами целевой.
При анализе известной системы сложных реакций, прежде всего, необходимо определить число стехиометрически независимых превращений, уравнения которых нельзя получить комбинацией уравнений других реакций (сложением, вычитанием, умножением стехиометрических коэффициентов на постоянные множители). В большинстве случаев это легко сделать последовательным исключением стехиометрически зависимых реакций. Так, при обратимом превращении уравнение обратной реакции легко получить, умножив уравнение прямой реакции на минус единицу. Следовательно, в этом случае имеется только одно независимое превращение.
Рассмотрим систему сложных реакций дегидратации этанола
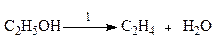


исключив реакцию -2 (как обратную второй) и реакцию 3 (уравнение которой можно получить вычитанием уравнения 2 из уравнения 1, находим, что система имеет лишь две независимые реакции.
В более сложных случаях для определения числа (R) стехиометрически независимых превращений используют методы матричной алгебры, составляя стехиометрическую матрицу, строки и столбцы которой соответствуют определенным веществам и реакциям. Для предыдущей системы стехиометрическая матрица будет такой:
| В = | -1 | |||
| -2 | ||||
| -1 | -1 | |||
| -1 |
Оказывается, что ранг стехиометрической матрицы равен числу независимых реакций. Ранг представленной матрицы равен 2.
Одновременно с числом независимых реакций определяют равное ему число так называемых ключевых веществ, по которым можно полностью охарактеризовать материальный баланс системы. В простой реакции ключевое вещество только одно (например, циклогексен из предыдущего примера). В сложных системах выбор независимых реакций и ключевых веществ взаимосвязан и определяется тем, чтобы в каждой независимой реакции участвовало хотя бы одно ключевое вещество и в то же время выбранные ключевые вещества участвовали бы только в одной или в некотором минимуме независимых реакций. Так, для дегидратации этанола выгодно выбрать в качестве независимых реакций 1 и 2, а в качестве ключевых веществ — этилен и диэтиловый эфир. Выбор ключевых веществ зависит также от простоты и точности их аналитического определения.
После анализа сложной системы превращений, выбора независимых реакций и ключевых веществ легко провести ее материальный расчет. Для каждой из независимых реакций по аналогии с выражением [2.3] можно записать уравнения полноты реакции


где индекс i соответствует веществу, а индекс j - реакции. Тогда, имея в виду, что каждое из веществ может участвовать в нескольких реакциях (Δ ni =ΣΔ nij), получим:
 [2.5]
[2.5]
Зная начальные условия и ni (или Fi) для ключевых веществ, находим вначале по уравнениям [2.5] полноту реакций nj или Fj и затем полный состав реакционной массы. Отметим, что при обратимых реакциях с единственным независимым превращением и одним ключевым веществом справедливы уравнения баланса, выведенные ранее для простых реакций, в том числе соотношения, иллюстрированные на рис. 2.2.
Пример.
При дегидратации этанола его начальный мольный поток Fc2h5он,0 = 1000 кмоль/ч,
Fc2h4=300 кмоль/ч и F(c2h5)2O = 200 кмоль/ч.
Рассчитать материальный баланс процесса.
Решение.
При независимых реакциях 1 и 2 (см. ранее) имеем:
Fc2h4 = 0 + 1F1 F1 = 300
F(c2h5)2O = 0 + 1F2 F2 = 200
Тогда
Fc2h5он = 1000 – 1*300 – 2*200 = 300 кмоль/ч
Fh2O = 0 + 1*300 + 1*200 = 500 кмоль/ч
На основе этого расчета составляется таблица материального баланса, в которой сопоставляются взятые и полученные количества веществ. Например, для предыдущего расчета получим:
| Наименование компонента | Подано | Получено | ||
| кмоль/ч | кг/ч | кмоль/ч | кг/ч | |
| Этанол | 1 000,0 | 46 000 | 300,0 | 13 800 |
| Этилен | 0,0 | 0,0 | 300,0 | 8 400 |
| Диэтиловый эфир | 0,0 | 0,0 | 200,0 | 14 800 |
| Вода | 0,0 | 0,0 | 500,0 | 9 000 |
| Итого: | 1 000,0 | 46 000 | 1 300,0 | 46 000 |
При балансовых опытах или подведении фактического материального баланса установки обычно наблюдается небольшое расхождение между суммами взятых и полученных веществ. Это объясняется неточностью анализов и неучтенными потерями. Материальные расчеты удобно проводить по независимым суммарным реакциям образования ключевых веществ из исходных реагентов. В рассмотренном выше примере они совпадают с соответствующими простыми реакциями, но в других случаях
бывает не так. Например, при этилировании бензола протекают следующие простые реакции:

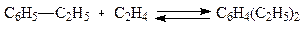

Стехиометрический анализ показывает, что из шести простых
реакций две являются независимыми. Столько же имеется и ключевых веществ, за которые можно принять два вещества - этилбензол и диэтилбензол. Суммарные реакции их образования из исходных реагентов таковы:


Одна из них совпадает с соответствующей простой реакцией, а
другая не совпадает и имеет иные стехиометрические коэффициенты, которые обозначим v′i. Выведенное ранее уравнение баланса [2.5] для сложных реакций применимо и для суммарных реакций. Поэтому дальнейший расчет при заданных начальных условиях и Fi (ni) для ключевых веществ проводится аналогично.
Уравнение [2.5] для суммарных реакций образования ключевых веществ служит для составления баланса по исходным реагентам, который часто необходим при исследовании или расчете процесса. Когда каждое из ключевых веществ образуется только по одной суммарной реакции, имеем:

Например, для разбираемого процесса этилирования бензола получим:


Безразмерные характеристики материального баланса реакций.
Как уже было сказано выше, в химии и химической технологии большое значение имеют безразмерные характеристики материального баланса – степень конверсии (степень превращения), селективность и выход.
Степень конверсии (степень превращения, конверсия) – доля прореагировавшего исходного реагента относительно его начального количества. Степень превращения реагента показывает, насколько полно в химико-технологическом процессе используется исходное сырье.
Конверсия реагента A
 [2.6]
[2.6]
В примере дегидратации этанола степень его конверсии составляет:
ХROH = (1000 – 300):1000 = 0,70 или 70,0%
Чаще всего в химической реакции участвует не один, а два реагента (или даже больше). При этом обычно степень конверсии определяют по основному реагенту А, но она может быть рассчитана по каждому реагенту, причем в общем случае не обязательно получаются равные результаты.
Степени превращения реагентов A и B, участвующих в реакции (I):
 ;
; 
Необходимо помнить, что конверсия – это доля первоначального количества реагента, т. е. пределы изменения Хi определяются соотношением  .
.
Если один из реагентов (например, реагент В) взят в избытке, то всегда
Х В < 1, даже в том случае, когда Х A = 1.
Обычно при выборе первоначального состава реакционной смеси берут в избытке более дешевый реагент (например, воздух, воду и т. д.) с целью повышения степени использования более ценного сырья.
В разных процессах химической технологии степень конверсии
изменяется от 4÷5 до почти 100%. Из уравнения [2.6] следует:
 [2.7]
[2.7]
 [2.8]
[2.8]
Для простых и обратимых реакций, когда имеются единственное независимое превращение и одно ключевое вещество, степень конверсии – вполне достаточная характеристика материального баланса. Действительно, зная ni,0 (Fi,0) и ХA, легко рассчитать FA по уравнению [2.7], n (F) по формуле [2.3] и затем все ni (Fi) по уравнению [2.4]. Кроме того, для любой простой или обратимой реакции

в дополнение к соотношению [2.7] легко вывести зависимость ni (Fi) от nА,0 (FА,0) и степени конверсии основного реагента ХА:

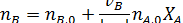

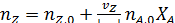
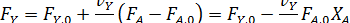

где | vA | - абсолютное значение стехиометрического коэффициента при реагенте А.
Не всегда возможно достичь полного использования реагента (т. е. условия X i = 1). Большинство химических реакций обратимы. Для обратимых реакций при заданных условиях их осуществления предельным является состояние химического равновесия.
Для сложных реакций, более одного ключевого компонента, степень конверсии показывает лишь долю прореагировавшего вещества, но не дает представления о направлениях его превращения, которое определяется селективностью и выходом.
Селективность — доля (или процент) превращенного исходного реагента, израсходованная на образование данного продукта. При этом всегда учитывают только химические превращения в реакторе, исключая какие-либо иные потери веществ (кроме их расходования на образование побочных продуктов). Другими словами, селективность можно определить как отношение количества полученного продукта к его теоретическому количеству, которое могло бы образоваться из превращенного реагента при отсутствии побочных реакций и потерь. Теоретическое количество легко рассчитать по суммарной реакции образования данного продукта из исходных реагентов, применяя к ней уравнения [2.3]:

Тогда получим выражение для селективности Ф
 [2.9]
[2.9]
в котором двойной индекс при Ф означает, что селективность определена для продукта i по основному реагенту А. Ее можно выразить и по другому реагенту. Когда исходное вещество является единственным или известно, по какому из реагентов определяется селективность, индекс А (или Y) может быть опущен.
Очевидно, что количество основного реагента, пошедшее на образование всех образующихся продуктов равно количеству затраченного основного реагента и, следовательно
 [2.10]
[2.10]
Так для ранее рассмотренного примера дегидратации этанола получим:


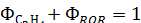
Селективность по целевому продукту показывает долю полезно использованного сырья; она является важной характеристикой катализаторов, условий проведения процесса и типа реакторного узла. На практике селективность по целевому продукту изменяется от 50÷60 до 100%, причем повышение селективности – одна из важнейших задач химической технологии.
Полная, или интегральная, селективность Ф – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные):

Мгновенной, или дифференциальной, селективностью Ф′ называют отношение скорости превращения исходных реагентов в целевой продукт к суммарной скорости расходования исходных реагентов;
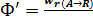
где w r(A→R) – скорость расходования реагента А по целевой реакции; w rA – суммарная скорость расходования реагента А.
Понятие дифференциальной (мгновенной) селективности имеет смысл только для параллельных реакций.
Выход – это далеко не однозначное понятие. Иногда под ним понимают абсолютное количество полученного продукта (в г, кг, моль и кмоль), но чаще выход выражают в долях единицы или в процентах на взятое сырье. Кроме того, выход применяют для характеристики систем разного масштаба – только реакционного аппарата (химический выход), какого-либо узла производства или технологической схемы в целом, когда учитывают не только расход сырья на химические реакции, но и различные потери (технологический выход). Далее мы будем применять понятие только химического выхода.
Химический выход равен мольному количеству полученного продукта i, отнесенному к его теоретическому возможному количеству. Следовательно, выражение для выхода легко получить из формулы [2.9] при ХА = 1:
 [2.11]
[2.11]
Выход можно рассчитывать и по второму реагенту, причем в литературе встречаются и другие обозначения выхода.
Объединяя формулы [2.9] и [2.11] получим, что выход равен произведению селективности на степень конверсии.
 [2.12] При этом сумма выходов ключевых веществ по основному реагенту А с учетом уравнения [2.10] равна степени конверсии этого реагента.
[2.12] При этом сумма выходов ключевых веществ по основному реагенту А с учетом уравнения [2.10] равна степени конверсии этого реагента.
 [2.13] Используя уравнение [2.11] мольные количества и мольные потоки можно выразить через их выходы.
[2.13] Используя уравнение [2.11] мольные количества и мольные потоки можно выразить через их выходы.

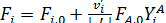 [2.14]
[2.14]

 [2.15]
[2.15]
Последние уравнения широко используются в химической кинетике и при расчете реакторов. Очевидно, что при расчете материальных балансов процесса все или часть исходных данных (за исключением ni,0 или Fi,0) может быть задана безразмерными характеристиками – степенью конверсии, селективностью или выходом. Тогда, используя выведенные уравнения, легко рассчитывают мольные количества или потоки всех веществ и составляют таблицу материального баланса.
Парциальные молярные балансы. На безразмерных характеристиках реакций основаны расчеты так называемых парциальных молярных балансов, составляемых на 1 моль основного исходного реагента А. При этом начальный состав смеси также выражают через безразмерные величины, а именно мольные соотношения других веществ, в том числе инертных, к основному реагенту А:
 [2.16]
[2.16]
Безразмерные формы уравнений баланса составляют по независимым суммарным реакциям, деля выражения полученные по формулам [2.5] на nА,0 или FА,0:


Здесь 
Величина  есть степень полноты или частная степень конверсии основного реагента по данной суммарной реакции, и обозначается как хj, изменяющаяся от 0 до 1. Если какое-либо ключевое вещество образуется только по этой реакции, то имеем
есть степень полноты или частная степень конверсии основного реагента по данной суммарной реакции, и обозначается как хj, изменяющаяся от 0 до 1. Если какое-либо ключевое вещество образуется только по этой реакции, то имеем

т.е. его выход равен степени полноты реакции. Следовательно, получаем уравнение парциального молярного баланса:  [2.17]
[2.17]
Рассчитаем парциальный молярный баланс реакции дегидратации этанола:

Согласно предыдущим расчетам, имеем:




Самостоятельная работа к лекции 2
1. Определить число независимых реакций
4NH3+5O2=4NO+6H2O
4NH3+3O2=2N2+6H2O
4NH3+6NO=5N2+6H2O
2NO+O2=2NO2
2NO=N2+O2
N2+2O2=2NO2
2. При окислении этилена протекают реакции

Составьте стехиометрическую матрицу, найдите число независимых реакций, выберите независимые реакции и ключевые вещества.
3. Для предыдущей реакции провести материальный расчет для условий:
начальный мольный поток этилена равен 150 кмоль/ч, степень его конверсии
0,40; селективность образования этиленоксида 0,70; мольное соотношение кислорода и этилена β = 0,60. Составьте таблицу материального баланса.
4. Для реакции из примера 2 составьте общие уравнения зависимости
мольных потоков веществ от начального мольного потока этилена, выходов этиленоксида и диоксида углерода.
Resume /CV
Resume is used exclusively in the USA. CV is used in Europe, America, Asia and Africa.
Дата добавления: 2014-12-15; просмотров: 158 | Поможем написать вашу работу | Нарушение авторских прав |
|