
Читайте также:
|
Основные технологические свойства катализаторов
При практическом применении большое значение имеют технологические характеристика промышленных катализаторов (активность, селективность, термическая устойчивость и т.д.).
Катализатор и равновесие химической реакции
При внесении катализаторов энергетический уровень реагирующих молекул не меняется. Действие катализатора не смещает равновесия простой реакции, а лишь ускоряет достижение равновесия при данной температуре. При этом катализатор ускоряет как прямую, так и обратную реакции:
 A ⇄ R ± Q
A ⇄ R ± Q
На графике зависимости ФR=f(τ) (где Ф*R
равновесный выход продукта) хорошо видно, что τ к < τ бк, где τк – время достижения равновесного выхода продукта при проведении реакции с катализатором; τбк – время достижения равновесного выхода при проведении той же реакции без катализатора.
Из графика видно, что Ф*R ≠ Ψ(кат)
Активность катализатора
Активность катализатора – мера ускоряющего действия катализатора по отношению к данной реакции.
Активность определяется как отношение констант скоростей каталитической и некаталитической реакции:
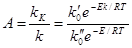 (5.4)
(5.4)
где Е – энергия активации реакции без катализатора,
Ек – энергия активации той же реакции с катализатором.
Для тех случаев, когда каталитическая и некаталитическая реакции имеют один порядок и, следовательно предэкспоненциальные коэффициенты в уравнении Аррениуса для них равны(k'0 = k''0), активность катализатора определяется из (5.4) как:
А = е∆Е/RT, (5.5)
где ∆Е = Е – Ек выражает снижение энергии активации под действием катализатора.
Если k'0 ≠ k''0, то k'0 / k''0 =N и A = N e∆E/RT
Ускоряющее действие катализатора можно наглядно проследить на примере окисления SO2 в SO3 (5.3). Основные характеристики данного процесса приведены для трех катализаторов (табл.5.1).
Таблица 5.1
Характеристика процесса окисления SO2 в SO3 с различными катализаторами
| Тип катализатора | Е, кДж/моль | Температура, °С | А | |
| процесса | зажиг-ия | |||
| Без катализатора | – | – | – | |
| Pt | 3·1013 | |||
| V2O5 | 4·1010 | |||
| Fe2O3 | 7·105 |
Чем выше активность катализатора, тем при более низкой температуре можно вести процесс. Это дает значительные экономические и технологические преимущества: увеличение равновесного и фактического выхода обратимых экзотермических реакций, уменьшение количества побочных продуктов, снижение расходного коэффициента по сырью, улучшение качества продукта.
Активность катализатора можно определить косвенно по температуре зажигания катализатора.
Дата добавления: 2015-02-22; просмотров: 232 | Поможем написать вашу работу | Нарушение авторских прав |