
Читайте также:
|
Какие вещества называют органическими?
Органическими веществами (соединениями) называются такие вещества или соединения, в состав которых входит углерод.
Ядро наиболее стабильного изотопа углерода массой 12 (распространенность 98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру гелия.
В основном состоянии 6 электронов углерода образуют электронную конфигурацию 1s22s22px12py12pz0. Четыре электрона второго уровня являются валентными, что соответствует положению углерода в IV группе периодической системы. Углерод имеет 2 электронных уровня. На внешнем электронном уровне 4 электрона.
Электронная структура невозбужденного атома углерода может быть выражена формулой 1 s 22 s 22 p 2, т. е. во втором (внешнем) электронном слое у него два спареных (с противоположными спинами) s-электрона и только два неспареных р -электрона, которые могут участвовать в образовании ковалентных связей. Следовательно, углерод должен был бы проявлять валентность, равную двум; однако в большинстве своих соединений он четырехвалентен — образует четыре ковалентные связи. Это объясняется тем, что при затрате некоторой энергии происходит «распаривание» 2 p -электронов: один из них переводится на свободную орбиту подуровня 2 р, и атом переходит в возбужденное состояние 2 s 2 p2 → 2 sp 3
или графически
 →
→ 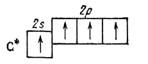
нормальное состояние возбужденное состояние
Дата добавления: 2015-01-30; просмотров: 199 | Поможем написать вашу работу | Нарушение авторских прав |
|