
Читайте также:
|
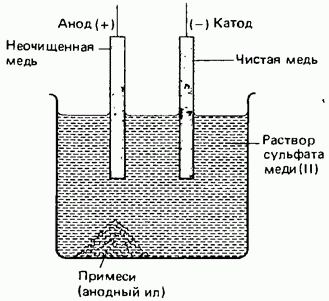
Очистка таких металлов, как медь и цинк, может осуществляться с помощью электролиза. Очистка металлов называется рафинированием (см. разд. 10.5). На рис. 10.7 схематически изображен процесс очистки меди. Неочищенная медь играет в этом процессе роль анода, а очищенная медь - роль катода; в качестве электролита может использоваться раствор сульфата  .
.
На аноде протекает полуреакция

Примеси, высвобождаемые при растворении неочищенной меди на аноде, опускаются на дно электролизера, образуя так называемый анодный ил. Этот ил может содержать драгоценные металлы, например золото и серебро. Переходящие в раствор ионы меди разряжаются и осаждаются на чистом медном катоде. Эта полуреакция описывается уравнением
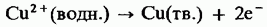
38. Коррозия металлов
Коррозия металлов (от позднелат. corrosio - разъедание), физико-химическое взаимодействие металлического материала и среды, приводящее к ухудшению эксплуатационных свойств материала, среды или технические системы, частями которой они являются. В основе коррозии металлов лежит химическая реакция между материалом и средой или между их компонентами, протекающая на границе раздела фаз. Чаще всего это - окисление металла.
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой.
Электрохимическая коррозия[править | править вики-текст]
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Дата добавления: 2015-02-16; просмотров: 143 | Поможем написать вашу работу | Нарушение авторских прав |