
Читайте также:
|
 Химическая термодинамика позволяет определить константу равновесия химической реакции при какой-либо температуре по уравнению изобары или изохоры химической реакции:
Химическая термодинамика позволяет определить константу равновесия химической реакции при какой-либо температуре по уравнению изобары или изохоры химической реакции:
Уравнение изобары химической ре-акции в дифференциальном виде (р=const)
 Уравнение изохоры химической ре-акции в дифференциальном виде (V=const)
Уравнение изохоры химической ре-акции в дифференциальном виде (V=const)
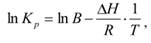 Уравнение, позволяющее рассчитать тепловой эффект химической реакции по константам равновесия при разных температурах:
Уравнение, позволяющее рассчитать тепловой эффект химической реакции по константам равновесия при разных температурах:
Уравнение прямой:
где ln В – постоянная интегрирования.
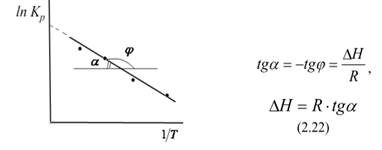 Полученное уравнение представляет собой уравнение прямой в координатах T Kp/1 ln, тангенс угла которой равен отношению теплового эффекта химической реакции к универсальной газовой постоянной. Эту зависимость можно использовать для графического нахождения теплового эффекта химической реакции:
Полученное уравнение представляет собой уравнение прямой в координатах T Kp/1 ln, тангенс угла которой равен отношению теплового эффекта химической реакции к универсальной газовой постоянной. Эту зависимость можно использовать для графического нахождения теплового эффекта химической реакции:
26 Влияние температуры, давления и добавки индифферентных газов на равновесие.
Принцип Ле-Шателье Влияние давления на смещение химического равновесия
 Давление влияет на химическое равновесие в газовой фазе и равновесие гетерогенных реакций с участием газообразных веществ. Для выяснения зависимости константы равновесия от давления используется константа равновесия, выраженная через мольные доли компонентов К х (К р и К с от давления не зависят).
Давление влияет на химическое равновесие в газовой фазе и равновесие гетерогенных реакций с участием газообразных веществ. Для выяснения зависимости константы равновесия от давления используется константа равновесия, выраженная через мольные доли компонентов К х (К р и К с от давления не зависят).
Из уравнения:
а) если в ходе химической реакции число моль компонентов увеличивается (Δν > 0), то при повышении общего давления (Р) константа равновесия, выраженная через мольную долю (К х), уменьшается. Равновесие сдвигается в сторону исходных веществ.
б) если в ходе химической реакции число моль компонентов уменьшается (Δν < 0), то при повышении общего давления (Р) константа равновесия, выраженная через мольную долю (К х), увеличивается. Равновесие сдвигается в сторону продуктов реакции.
в) если в ходе химической реакции число моль компонентов не меняется (Δν = 0), то изменение давления не влияет на положение равновесия химической реакции.
 Аналогично трактует влияние давления и принцип Ле-Шателье: при повышении давления равновесие сдвигается в сторону образования веществ, занимающих меньший объем.
Аналогично трактует влияние давления и принцип Ле-Шателье: при повышении давления равновесие сдвигается в сторону образования веществ, занимающих меньший объем.
Направление химической реакции позволяет предвидеть уравнение изобары химической реакции:
Выражение d ln Kp / dT называется температурным коэффициентом константы равновесия, знак которого определяется только знаком теплового эффекта (R>0, Т 2>0).Определение знака теплового эффекта процесса, при расчете которого возможны три случая:
а) если реакция эндотермическая (ΔН > 0), то 0 / ln dT K dp, с увеличением температуры константа скорости химической реакции тоже увеличивается, равновесие сдвигается в сторону образования продуктов реакции.
б) если реакция экзотермическая (ΔН < 0), то 0 / ln dT K dp, с увеличением температуры константа скорости химической реакцииуменьшается, равновесие сдвигается в сторону образования исходных веществ.
в) если ΔН = 0, то 0 / ln dT K dp, константа равновесия от температуры не зависит.
Дата добавления: 2015-01-30; просмотров: 218 | Поможем написать вашу работу | Нарушение авторских прав |