
|
Читайте также: |
ХИМИЯ ЭЛЕМЕНТОВ
Получение. В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:

Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
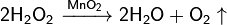
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:

К лабораторным способам получения кислорода относится разложение оксида ртути(II) (при t = 100 °C):
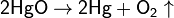
На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:

Так же кислород разлагается при разложении нитратов.
Химические свойства. Кислород энергично реагирует со многими веществами- простыми и сложными. Взаимодействие веществ с кислородом является реакцией окисления. Наиболее известная из этих реакций сопровождается выделением света и тепла. Это реакция горения. Продуктами реакции окисления являются сложные вещества - оксиды, состоящие из двух элементов, один из которых кислород.
Энергично сгорают в кислороде уголь, фосфор, железо, водород и другие вещества.
Способны реагировать с кислородом и сложные вещества, при горении образуются оксиды элементов, из которых состоит сложное вещество.
Например, СН4 + 2О2 = СО2 + 2Н2О (горение метана)
С металлами
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
3 Fe +2 O2 = Fe3O4
4Li + O2 = 2Li2O
HO!2Na + O2 = 2Na2O2
2K + O2 = 2K2O2
С неметаллами
C + O2 = CO2
S + O2 = SO2
4P + 5O2 = 2 P2O5
4P + 3O2 (недостаток) = 2 P2O3
2H2 + O2 = 2H2O
Со сложными веществами
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2H2S + 3O2 = 2SO2 + 2H2O
SiH4 + 2O2 = SiO2 + 2H2O
4NH3 + 3O2 = 2N2 + 6H2O
Дата добавления: 2015-02-16; просмотров: 94 | Поможем написать вашу работу | Нарушение авторских прав |