
Читайте также:
|
Фазовое равновесие- одновременное существование термодинамически равновесных фаз (См. Фаза) в многофазной системе. Простейшие примеры – равновесие жидкости со своим насыщенным паром, равновесие воды и льда при температуре плавления, расслоение смеси воды с триэтиламином на два несмешивающихся слоя (две фазы), отличающихся концентрациями. В равновесии могут находиться (в отсутствии внешнего магнитного поля) две фазы ферромагнетика с одинаковой осью намагничивания, но различным направлением намагниченности; нормальная и сверхпроводящая фазы металла во внешнем магнитном поле и т.д. Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях. Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
24. Критерии самопроизвольности процессов. Смещение химического равновесия. Принцип Ле Шателье. Влияние различных факторов на химическое равновесие.
Процессы, протекающие без подвода энергии от внешнего источника, называются самопроизвольными. Самопроизвольно протекает большинство экзотермических реакций (  ): реакции горения, образования ржавчины на металле, взаимодействия активных металлов с растворами кислот и водой и пр. Но существуют самопроизвольные и эндотермические процессы, например, растворение некоторых солей в воде. Следовательно, кроме энтальпийного фактора (
): реакции горения, образования ржавчины на металле, взаимодействия активных металлов с растворами кислот и водой и пр. Но существуют самопроизвольные и эндотермические процессы, например, растворение некоторых солей в воде. Следовательно, кроме энтальпийного фактора ( 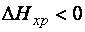 ) имеется другая движущая сила самопроизвольных процессов. Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа. Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
) имеется другая движущая сила самопроизвольных процессов. Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа. Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C.Влияние инертных газав Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов. Влияние концентрации на состояние равновесия подчиняется следующим правилам: При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
25. Общие понятия о растворах. Электролиты и неэлектролиты. Растворимость и растворение. Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. "Гомогенный" - значит, каждый из компонентов распределён в массе другого в виде своих частиц, то есть атомов, молекул или ионов. Электролиты - это вещества, растворы или расплавы которых проводят электрический ток.
К электролитам относятся щелочи, растворимые соли и кислоты. В водных растворах электролиты распадаются на ионы. Неэлектролиты - вещества, растворы которых не проводят электрический ток. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др. Растворимость Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях). Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
26. Термодинамика растворения. Давление пара раствора. Фазовые переходы в растворах. Согласно второму началу термодинамики при р, Т = = const вещества самопроизвольно могут растворяться в каком-либо растворителе, если в результате этого процесса энергия Гиббса системы уменьшается, т. е. Фазовые переходы первого рода — фазовые переходы, при которых скачком изменяются первые производные термодинамических потенциалов по интенсивным параметрам системы (температуре или давлению). Переходы первого рода реализуются как при переходе системы из одного агрегатного состояния в другое, так и в пределах одного агрегатного состояния (в отличие от фазовых переходов второго рода, которые происходят в пределах одного агрегатного состояния). при переходе системы из одного агрегатного состояния в другое: кристаллизация (переход жидкой фазы в твердую), плавление (переход твердой фазы в жидкую),конденсация (переход газообразной фазы в твердую или жидкую), возгонка (переход твердой фазы в газообразную), эвтектическое, перитектическое и монотектическое превращения.
в пределах одного агрегатного состояния: эвтектическое, перитектическое и полиморфное превращения, распад пересыщенных твердых растворов, распад (расслоение) жидких растворов, упорядочение твердых растворов. Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниям вещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход. При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Подчеркнём: имеется в виду скачкообразное изменение этих величин при изменении температуры, давления и т. п., а не скачкообразное изменение во времени.
27. Растворы. Закон Рауля. Осмос и осмотическое давление. Закон Вант-Гоффа. Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

На поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силымежмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Частицы раств вещ-ва и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объёму раствора. Диффузия - самопроизв процесс перемещения частиц вещ-ва, приводящий к вырав-ю концентрации раствора. Если растворы с различной конц-ией разделить полупроницаемой мембраной, пропускающей только молекулы раств-ля (бычий пузырь, цалафан), то диффузия может стать односторонней. если в сосуд из полупрониц мембраны, переходящий в узкую трубку, поместить раст-р сахарозы и погрузить в чистую воду, то вырав-ие кон-ии будет происходить только за счет молекул воды, кот в большем кол-ве диф-ют в раст-р чем обратно. Такая одностор диффузия называется осмосом. в сосуде с раствором созд-ся давление, под действ кот жидкость подним-ся в трубке пока не наступит равновесие между р-ом и раст-ем. Осмотическое давление - это то давление, которое необходимо приложить раствору, что прекратился осмос. это то избыт давление, кот оказывает р-ор на полупрониц перегородку в момент его равновесия с раств-ем. При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. В 1886 Вант - Гофф показал, что для растворов не электролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается уравнением: Р=СmRТ Здесь Р-осмотическое давление раствора, Па; С - его мольно-объемная концентрация (молярность), моль/л; R- универсальная газовая постоянная, 8,314 Дж/(моль*К); Т - абсолютная температура раствора. Молярность раствора С представляет собой отношение числа молей растворенного вещества n к объему раствора V (л) С=n/V а число молей вещества равно его массе m, делённой на мольную массу М. Отсюда для молярности раствора получаем С=m/MV Представляя это значение С в уравнение Вант-Гоффа, найдём pV=1000m/M*RT Это уравнение позволяет по величине осмотического давления раствора определять мольную массу. стенки растит клеток, живых орг-ов пред-ют полупрон мембрану, через кот свободно проходят мол-лы воды, но зад-ся вещ-ва, раствор-ие в клеточном соке.
Дата добавления: 2015-02-16; просмотров: 180 | Поможем написать вашу работу | Нарушение авторских прав |