
Читайте также:
|
РОСТОВСКИЙ ОРДЕНА ТРУДОВОГО
КРАСНОГО ЗНАМЕНИ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для студентов I-го курса дневного отделения
биолого-почвенного факультета
О Б Щ А Я Х А Р А К Т Е Р И С Т И К А
Г А Л О Г Е Н О В
г. Ростов на Дону
2002 г.
Бикяшев Э.А., Лисневская И.В.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
для студентов I-го курса дневного отделения
биолого-почвенного факультета
О Б Щ А Я Х А Р А К Т Е Р И С Т И К А
Г А Л О Г Е Н О В
Печатается по решению кафедры общей и неорганической
химии Ростовского ордена Трудового Красного Знамени госу-
дарственного университета.
Протокол N 2 от 18 февраля 2002г.
Рецензент – доктор хим.наук, е.Трубников И.Л.
Ответственный редактор - д-р.хим.наук, проф.Лупейко Т.Г.
С О Д Е Р Ж А Н И Е
1 Положение элементов в периодической системе..............................4
2 Электронное строение атомов, валентные возможности,
степени окисления..................................................................................5
3 Изменение радиусов атомов..............................................................6
4 Изменение устойчивости отрицательной степени окисления..........7
5 Изменеие устойчивости положительных степеней окисления.......10
6 Сравнительная характеристика однотипных содинений
галогенов..........................................................................................13
6.1 Характеристика свойств простых веществ....................................13
6.2 Характеристика свойств галогенидов............................................16
6.3 Характеристика свойств однотипных кислородсодержащих
кислот и их солей............................................................................19
Приложение.....................................................................................22
1 ПОЛОЖЕНИЕ ЭЛЕМЕНТОВ
В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ

|
Галогенами называют элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, иод и астат. Поскольку орбитальные атомные радиусы в периодах уменьшаются, валентные электроны очень прочно удерживаются ядрами атомов галогенов. По этой причине галогены имеют самые высокие потенциалы ионизации в своих периодах (если не принимать во внимание инертные элементы). Исключение составляет только астат, что является следствием уменьшения потенциалов ионизации в подгруппе галогенов. Высокие ионизационные потенциалы объясняют очень слабые восстановительные свойства галогенов (фтор вообще не обладает такими свойствами), полное отсутствие металличности. В то же время именно маленькие радиусы атомов и строение внешней электронной оболочки ns2np5 (n - номер периода) предопределяет высокое сродство галогенов к электрону (Ee): присоединяемый электрон достаточно сильно взаимодействует с ядром, к тому же, при этом происходит дополнительная стабилизация электронной конфигурации. В свою очередь, высокие значения Eе и электроотрицательности - одна из причин того, что галогены являются самыми сильными окислителями в своих периодах (фтор - самый сильный окислитель среди простых веществ).
Эти свойства галогенов, казалось бы, очень сильно отличают их от элементов побочной подгруппы, в которую входят типичные металлы. Однако в высшей, групповой (+7) степени окисления элементы обеих подгрупп нередко образуют сходные по свойствам однотипные соединения. С одной стороны, это обусловлено довольно высоким, а в случае Cl+7 и Mn+7 очень высоким поляризующим действием атомов соответствующих элементов, что, в свою очередь, предопределяет ковалентный характер связи, кислотные свойства оксидов и гидроксидов. С другой стороны, у марганца, так, как и у галогенов, высшая степень окисления не стабильна, что влечет за собой сильные окислительные свойства соответствующих соединений. Например:
Cl2O7 и Mn2O7 - неустойчивые вещества, взрывоопасные жидкости; кислотные оксиды; сильные окислители.
HClO4 и HMnO4 - очень сильные кислоты; малоустойчивые соединения: HMnO4 существует только в водных растворах, HClO4 выделена в свободном виде, но способна к разложению со взрывом. Сами кислоты и их соли являются сильными окислителями (ClO4-- ион в разбавленных водных растворах достаточно стабилен, а поэтому окислительные свойства проявляет плохо).
2 ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ,
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ,
СТЕПЕНИ ОКИСЛЕНИЯ
Электронное строение атомов галогенов находится в полном соответствии с их положением в периодической системе: на внешнем, валентном энергетическом уровне атомов находится по семь электронов:
F 1s2 2s22p5


Cl 1s2 2s22p6 3s23p53d0



Br 1s2 2s22p6 3s23p63d10 4s24p54d0




I 1s2 2s22p6 3s23p63d10 4s24p54d104f0 5s25p55d0




At 1s2 2s22p6 3s23p63d10 4s24p54d104f14 5s25p55d10 6s26p56d0






Сходство в электронном строении внешней электронной оболочки, высокая электроотрицательность в сочетании с достаточно большими величинами потенциалов ионизации объясняют близость свойств как простых веществ, так и сложных однотипных соединений галогенов. Так, например, наиболее важными в химии галогенов являются нечетные степени окисления от -1 до +7. В степени окисления минус один галогены образуют галогеноводороды НГ, разнообразные галогениды: ионные NaГ, ВаГ2; ионно-ковалентные полимерные: ВеГ2, АlГ3 (фториды Ве и Аl - высоко-ионные соединения); ковалентные молекулярные: РГ3, S2Г2, СГ4 и др. Среди соединений хлора и его аналогов в положительных степенях окисления наиболее известны кислородсодержащие кислоты НГО, НГО2, НГО3, НГО4, а также их соли.
|
В то же время, уже из электронных формул видно, что атомы галогенов отличаются строением внутренних (в том числе, предвнешнего) энергетических уров-ней.В дальнейшем (разд.5) мы увидим, как это отражается на стабильности высшей положительной (+7) степени окисления в подгруппе. Да и сходство в строении валентного энергетического уровня далеко не полное. В частности атом фтора отличается от хлора и его аналогов отсутствием внешних d-орбиталей. Это ограничивает валентные возможности фтора в его ковалентных соединениях, так как больше 4‑х общих электронных пар такой атом образовать не сможет. Наличие свободных 3d-орбиталей в атоме хлора позволяет ему образовывать дополнительные связи или за счет возбуждения атома, или по донорно-акцепторному механизму. Но образовать, допустим, семь s‑связей атом хлора не может из-за относительно маленького размера. Однако с увеличением числа электронных оболочек от F к J и Аt происходит рост радиусов атомов. Это приводит к повышению возможных координационных чисел галогенов в тех соединениях, где они выступают в роли центрального атома, вокруг которого располагаются атомы-партнеры: СlF3, ВrF5, JF7; HClО4 - "HBrO4"- Н5JO6. Для более эффективного использования d-орбиталей в образовании связей желательно понизить их энергию (приблизить к валентным s- и р‑орбиталям). Этому способствует перевод атома в положительную степень окисления. Причем, чем больше будет положительный заряд на атоме галогена, тем более сильным акцептором он будет, тем более прочные связи будет образовывать с участием своих d‑орбиталей. В свою очередь, величина положительного заряда будет определяться как степенью окисления элемента, так и его электро-отрицательностью. Поэтому, в однотипных соединениях реальный положи-тельный заряд на атоме иода будет больше, чем на атоме хлора  , и, как следствие, H5IO6 - более стабильное соединение.
, и, как следствие, H5IO6 - более стабильное соединение.
Таким образом, уже из этого краткого анализа можно сделать вывод, что в химии галогенов, наряду с определенной общностью свойств, будут и заметные отличия. А поэтому, прежде чем переходить к обсуждению свойств соединений галогенов, необходимо выяснить закономерности изменения важнейших характеристик атомов элементов подгруппы.
3 ИЗМЕНЕНИЕ РАДИУСОВ АТОМОВ

|
Как отмечалось в предыдущем разделе, радиусы атомов в подгруппе галогенов растут с увеличением порядкового номера элементов. Однако, несмотря на то, что число электронных слоев каждый раз увеличивается на единицу, рост радиусов атомов (ионов) происходит немонотонно. Это связано с тем, что в ряде случаев увеличение размеров атомов замедляется так называемыми эффектами d- и f-сжатия. Они сказываются на изменениях радиусов в том случае, когда у сравниваемых атомов строение предвнешнего электронного слоя отличается по степени заполненности d- и f- орбиталей. В подгруппе галогенов это наблюдается при переходе от Сl к Вr (3d-сжатие) и от J к At (более сильное 4f- сжатие). В атомах F и Cl в предвнешнем энергетическом уровне вообще нет ни d-, ни f- орбиталей, а в атомах Br и J одинаково заполнены 3d- и 4d- подуровни, соответственно. Поэтому рост радиусов в этом случае определяется только увеличением числа электронных слоев (рис.1; Приложение, табл.1).
4 ИЗМЕНЕНИЕ УСТОЙЧИВОСТИ
ОТРИЦАТЕЛЬНОЙ СТЕПЕНИ ОКИСЛЕНИЯ

|
Устойчивость степени окисления минус один может быть оценена с использованием следующей схемы:
Для реализации отрицательной степени окисления требуется разорвать химическую связь в молекулах простых веществ (этап I), присоединить дополнительный электрон к атому галогена (II) и, наконец, необходимо, чтобы установилась химическая связь с ионом (К+, Н+) другого элемента и образовался продукт реакции1 (этап III). Переход в целом будет тем выгодней, степень окисления минус один будет тем стабильней, чем меньше будут затраты энергии на атомизацию и чем полнее они будут компенсироваться за счет энергии, выделяющейся на II и III этапах. Поэтому, прежде, чем обсуждать стабилизацию степени окисления минус один в подгруппе галогенов, нужно выяснить закономерности изменения DНатом (Ехим.св.) в простых веществах, а также характер изменения сродства к электрону.
В общем случае энергия химической связи зависит от многих факторов. Однако, для характеристики большинства важнейших, наиболее распространенных соединений нам, как правило, будет достаточно учесть следующие: а) длина связи; б) кратность связи; в) характер связи (доля ковалентного механизма во взаимодействии тех или иных атомов). Причем последний фактор в химии галогенов в подав-ляющем большинстве случаев заметной роли не играет (конечно, если сравниваются однотипные соединения).

|

|

|
Сравним вначале энергию химической связи в простых веществах. Поскольку при переходе от F к At происходит увеличение радиусов атомов, в этом же ряду будет расти длина связи в молекулах галогенов, а при одинаковой кратности связи это должно приводить к уменьшению ее энергии. Т.е. самой прочной должна быть молекула фтора. На самом деле самой устойчивой среди галогенов является молекула хлора (рис.3, табл.2). Такое неожиданное, на первый взгляд, увеличение энергии связи Г-Г при переходе от F2 к Cl2 объясняется повышением кратности связи. В молекуле фтора она равна единице. Единственная связь образуется по обменному механизму за счет "лобового" перекрывания 2р-орбиталей взаимодействующих атомов. В молекуле хлора возможно дополнительное p-взаимодействие по донорно-акцепторному механизму. В результате кратность связи достигает ~1.25. У аналогов хлора на внешнем уровне также имеются свободные d‑орбитали, поэтому в молекулах этих галогенов (Br2, J2, At2) тоже осуществляется частичное p-связывание. Однако, по причине увеличения длины связи, прочность соответствующих молекул последовательно снижается. Но все-же по химической активности иод и астат заметно уступают хлору и брому. Это обусловлено наличием кристаллической решетки и гетерогенным характером реакций с участием иода и астата. В итоге можно сделать вывод, что в подгруппе хлора легче всего активировать хлор и бром, а в паре фтор-хлор меньше энергии требуется для активации фтора (см. рис.2).
Сродство к электрону в подгруппе галогенов, как и в других главных подгруппах, меняется немонотонно (Приложение, табл.1). Аномально высокое значение Ее наблюдается у элементов III-го периода. Причина этого явления разбирается в мет. указ. "Общая характеристика элементов VI группы периодической системы" (стр.7). Таким образом, среди галогенов дополнительный электрон легче всего присоединяет к себе атом хлора. Ему несколько уступают фтор и бром. В итоге по сумме первых двух этапов хлор и фтор имеют лучшие и близкие “показатели”.
Закономерности изменения энергии связи в галогенидах обсудим на примерах ионных галогенидов калия и ковалентных галогеноводородов. Галогениды калия имеют кристаллическую решетку типа NaCl. В соответствии с ростом радиуса галогенид-иона увеличиваются межионные расстояния и, в результате, уменьшается энергия связи К ¾ Г. Химическую связь в кристаллических веществах принято характеризовать энергией кристаллической решетки: как и энергия единичной связи, она уменьшается в ряду от фторидов к иодидам. И это сказывается на изменениии температур плавления галогенидов (табл. 1).
В случае ковалентных соединений (HГ) кроме учета длины связи нужно выяснить возможность дополнительного p-взаимодействия. Однако во всех галогеноводородах кратность связи не может быть больше единицы, т.к. в данных молекулах атом водорода свою единственную валентную 1s‑орбиталь использует для образования s-связи по обменному механизму и не может быть ни донором, ни акцептором электронных пар.2
Таблица 1
Некоторые константы
ионных (КГ) и ковалентных (НГ) галогенидов.
Константы KF KCl KBr KI HF HCl HBr НI
Ехим.св. , кДж/моль 497 425 382 325 566 432 363 298
Екр.р-ки, кДж/моль 812 712 671 632
Тпл., оС 857 776 730 686
Таким образом, независимо от типа связи, самыми прочными оказываются фториды, при их образовании выделяется максимальная энергия (табл.1). Поэтому именно для фтора оказывается самым выгодным третий этап предложенной на стр.7 схемы. Теперь уже можно, руководствуясь данной схемой, с учетом всех предыдущих рассуждений сделать вывод, что в подгруппе галогенов стабилизация степени окисления минус один падает с увеличением порядкового номера элемента: у хлора она наиболее устойчива среди его аналогов, но в то же время хлор в этом плане уступает фтору. Причем, при помощи очень несложных подсчетов можно убедиться, что решающую роль в таком характере изменения стабильности отрицательной степени окисления играет энергия связи в галогенидах, поскольку энергетические эффекты первых двух этапов в значительной степени компенсируют друг друга.
5 ИЗМЕНЕНИЕ УСТОЙЧИВОСТИ
ПОЛОЖИТЕЛЬНЫХ СТЕПЕНЕЙ ОКИСЛЕНИЯ

|
Реализация положительных степеней окисления предполагает отрыв того или иного числа валентных электронов от атома. С учетом этого следует несколько изменить схему, предложенную на стр.7. В частности, энергетика II-го этапа в этом случае будет определяться величиной потенциалов ионизации (Ii).
Поскольку на внешнем энергетическом уровне атомов галогенов присутствуют электроны разных типов, то энергию, необходимую для их удаления, принято подразделять на низшие и высшие потенциалы ионизации. При затрате низших потенциалов ионизации атомы последовательно теряют свои p‑электроны, и при этом могут быть реализованы низшие положительные степени окисления (+1, +3, +5). Высшая степень окисления +7 соответствует удалению, кроме того, и двух s-электронов.

|
Обсудим вначале закономерности стабилизации низших положительных степеней окисления. Как было показано ранее, DНатом. по подгруппе уменьшается, следовательно минимальные энергетические затраты требуются на активацию иода и астата, а труднее всего эту стадию осуществить в случае хлора. При анализе II-го этапа следует сравнить низшие ионизационные потенциалы. Поскольку в случае р-электронов Ii зависят, главным образом, только от радиуса атома, отрыв первых пяти электронов облегчается при переходе от фтора к хло
ру и далее к астату. Причем характер изменения I1-5 зеркально противоположен графику увеличения радиусов атомов и ионов: в тех случаях, когда рост радиуса замедляется из-за d- или f-сжатия, потенциалы ионизации тоже меняются не так сильно (рис. 4, Приложение, табл. 2). Что касается энергии связи в продуктах (однотипных анионах ГОm-), то она растет, несмотря на увеличивающуюся длину связи. Это вызвано повышением кратности связей Г¾О по мере увеличения разности электроотрицательностей соответствующих атомов (кислорода и галогена). Атомы иода образуют более прочные p-связи за счет своих d-орбиталей (см. стр.6). В итоге мы можем сделать вывод, что по подгруппе происходит постепенная стабилизация низших положительных степеней окисления.
Для достижения высшей положительной степени окисления требуется задействовать в образование связей s-электроны, s-орбитали атомов галогенов. А это будет во многом зависеть от высших ионизационных потенциалов и от валентных возможностей s-подуровня данных элементов, т.е. от того, насколько сильно отличаются по энергии s- и p-орбитали. Характер изменения 6-го и 7-го потенциалов ионизации (которые зависят и от радиусов атомов, и от эффекта проникновения), в целом, мало отличается от того, как меняются высшие потенциалы ионизации в подгруппе халькогенов (Метод. указание "Общая характеристика элементов VI группы периодической системы", стр.10, рис.1.1). И в данном случае наблюдается некоторое замедление спада I6,7 при переходе к элементу IV периода (Br), а при переходе к астату значения высших потенциалов ионизации даже увеличивается (как и при переходе к Po в подгруппе халькогенов). Однако эти аномалии выражены в меньшей степени, так, что можно говорить о заметной дестабилизации степени окисления +7 на данном этапе только у астата (см. рис.5). Теперь осталось выяснить, атом какого элемента образует наиболее прочные связи в анионе ГО4-. С одной стороны, как и в случае низших степеней окисления, их устойчивость должна расти в связи с уменьшением электроотрицательности галогена и повышением, тем самым, разности электроотрицательностей в паре галоген - кислород. Но в то же время нужно учитывать, что образование таких ионов требует участия в образовании связей s-орбиталей "центрального атома": он при этом должен находиться в sp3-гибридном состоянии. А этот процесс будет сильно затруднен при условии большой разницы в энергиях s- и p-орбиталей валентного слоя. Аномально большой энергетический зазор между этими орбиталями возникает вследствие разной проникающей способности s- и p-электронов. Первые довольно много времени проводят под экраном d- или f-электронов предвнешнего слоя. За счет этого они усиливают свое взаимодействие с ядром и понижают энергию. Как можно наблюдать на примере высших потенцалов ионизации, эти эффекты наиболее сильно проявляются в атомах астата и брома (Приложение, табл.2). Следовательно, в анионах BrO4- и, особенно, AtO4- должна быть заметно понижена энергия связей Г¾О. А это, в свою очередь, затрудняет компенсацию тех энергетических за-трат, которые необходимы на активацию исходных веществ и ионизацию атомов (особенно, в случае астата). Поэтому неудивительно, что соединения At+7 пока не получены, а бромат-ион крайне нестабилен и является "суперокислителем".
6 СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ОДНОТИПНЫХ СОЕДИНЕНИЙ ГАЛОГЕНОВ
6.1 Х а р а к т е р и с т и к а с в о й с т в
п р о с т ы х в е щ е с т в
Все галогены являются молекулярными веществами (состав молекул Г2), типичными неметаллами, диэлектриками. При обычных условиях фтор - почти бесцветный газ, хлор - газ желто-зеленого цвета, бром - темно-коричневая жидкость, а иод представляет собой кристаллическое вещество фиолетового цвета. При переходе от фтора к иоду последовательно увеличиваются температуры плавления и кипения галогенов (иод плавится только под повышенным давлением паров I2, в противном случае он из твердого состояния при нагревании непосредственно переходит в газообразное, т.е. сублимирует или возгоняется). Изменение агрегатного состояния, температур плавления и кипения в подгруппе галогенов является прямым результатом повышения энергии межмолекулярного взаимодействия. Поскольку молекулы Г2 неполярны, то единственным механизмом межмолекулярного взаимодействия в данном случае является дисперсионный.
Таблица 2
Некоторые характеристики галогенов
F2 Cl2 Br2 I2 At2
Ехим.св.Г-Г, кДж/моль 155 243 190 149 117
DНисп., кДж/моль 7 20 30 42 ¾
Тпл., оС -220 -101 -7 114 244
Ткип., оС -188 -34 59 186 309
Энергия такого взаимодействия определяется поляризуемостью (деформируемостью) молекул, что, в свою очередь, зависит от размеров их электронных облаков. Усиливающееся межмолекулярное притяжение в случае брома и иода приводит к объединению соответствующих молекул, что сопровождается образованием жидкой и твердой фаз. В хлоре и фторе это взаимодействие настолько невелико, что кинетической энергии молекул оказывается достаточно, чтобы его преодолеть. Соответственно, эти вещества в обычных условиях имеют газообразное состояние.
Природой межмолекулярного взаимодействия объясняется разная растворимость галогенов в воде и в органических растворителях. Молекулы органических веществ, как правило, малополярны, поэтому также склонны, главным образом, к дисперсионному взаимодействию. Это облегчает однородное распределение молекул галогенов в таких растворителях. Сильно полярные молекулы воды предрасположены к ориентационному взаимодействию (например, при гидратации ионов), а также образуют очень прочные водородные связи. Молекулы же галогенов не способны эффективно участвовать в такого рода взаимодействиях.
Растворимость галогенов в одном и том же растворителе, как правило, уменьшается при переходе к Br2 и I2, т.к. в этих случаях для растворения требуется разрушить относительно прочные межмолекулярные связи в галогенах.
Ну и, наконец, следует отметить, что фтор не растворяется в воде, а разлагает, окисляет ее:
2F2 + H2O  2HF + OF2 (O2, O3)
2HF + OF2 (O2, O3)
Характеристику химических свойств следует начать с анализа реакционной способности галогенов. Самым активным среди них является фтор, что обусловлено низкой энергией связи в молекуле F2. Хлор и бром мало отличаются друг от друга по химической активности, а реакционная способность иода при обычных условиях занижена по причине образования кристаллической решетки: при низких температурах реакции с участием иода являются гетерогенными, и их скорость определяется площадью поверхности раздела взаимодействующих веществ. Высокая активность фтора проявляется в том, что он взаимодействует даже с такими устойчивыми, инертными веществами, как оксид кремния, благородные газы и т.п.:
SiO2 + 2F2  SiF4 + O2
SiF4 + O2
2Au + 3F2  2AuF3
2AuF3
Во всех этих реакциях фтор выступает в качестве окислителя. При этом атомы фтора понижают степень окисления от нуля до минус одного, чему способствует высокая энергия связи в получающихся фторидах (см. разд.4). Типичными окислителями в самых разнообразных реакциях являются и все остальные галогены. Однако, поскольку стабильность степени окисления минус один по подгруппе падает, окислительные свойства галогенов в ряду от фтора к иоду (астату) уменьшаются. Наглядным примером, иллюстрирующим закономерности в изменении химической активности, окислительной способности галогенов является их отношение к водороду. Фтор энергично взаимодействует с водородом даже в темноте при обычных температурах. Реакция протекает по цепному механизму и сопровождается взрывом. Хлор также со взрывом окисляет водород, но для инициирования этой реакции требуется или кратковременный нагрев, или воздействие ультрафиолетового излучения. Бром и иод реагируют с водородом только при постоянном нагревании (в последнем случае требуется более высокая температура). Причем, из-за низкой устойчивости иодоводорода, он в этих условиях заметно разлагается, поэтому реакция синтеза HI оказывается обратимой:




За исключением фтора все галогены обладают и восстановительными свойствами, которые повышаются при переходе от хлора к иоду и астату в соответствие с ростом устойчивости низших положительных степеней окисления. Наиболее типичной реакцией, в ходе которой галогены проявляют свои восстановительные свойства является их диспропорционирование при частичном взаимодействии с водой. Причем, реализация тех или иных положительных степеней окисления (наряду с минус один) строго коррелирует с изменением восстановительных свойств. Например, в случае хлора получается хлорноватистая кислота:
Cl2 + H2O  HCl + HOCl
HCl + HOCl
тогда, как при диспропорционировании иода основным продуктом окисления является иодноватая кислота:
I2 + H2O  HI + HIO3
HI + HIO3
Увеличить полноту протекания этих процессов можно в щелочной среде. В этом случае один из продуктов реакций (протоны) связываются в малодиссоциирующий электролит (воду), что приводит к смещению соответствующих равновесий:

Закономерности изменения как окислительных, так и восстановительных свойств в подгруппе галогенов четко проявляются в реакциях между ними - в качестве окислителя всегда выступает галоген с меньшим порядковым номером: а) в газовой фазе:

б) в водном растворе:
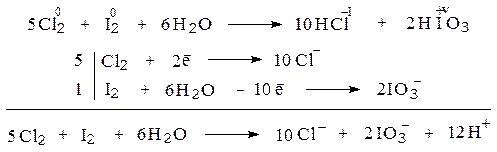
6.2 С р а в н е н и е с в о й с т в г а л о г е н и д о в

|
Среди соединений галогенов в степени окисления минус один важнейшими являются галогеноводороды. При обычных условиях (выше 20 0С) они представляют собой бесцветные газообразные вещества с резкими запахами. Галогеноводороды имеют молекулярное строение, поэтому их агрегатное состояние, а также температуры плавления и кипения определяются энергией межмолекулярного взаимодействия. Поскольку молекулы HI, HBr и HСl относительно малополярны, основным типом взаимодействия между ними является дисперсионный. Его энергия, как известно, определяется поляризуемостью, размерами молекул и, следовательно, максимальна в иодоводороде, а при переходе к HBr и HI последовательно уменьшается. Это сказывается и на температурах плавления и кипения (табл. 2, рис. 6). Если бы и в HF преобладающим типом межмолекулярного взаимодействия оставался дисперсионный, то изменения агрегатных состояний в этом случае наблюдались бы при самых низких для галогеноводородов температурах. Однако, на самом деле HF имеет неожиданно, аномально высокие Тпл и Ткип. Это является результатом особого типа ориентационного взаимодействия, получившего название водородная связь.3
Таблица 2
Температуры плавления и кипения галогеноводородов
HF HCl HBr HI
Эффективный заряд
на атоме галогена -0.42 -0.17 -0.12 -0.05
Тпл, 0С -83 -114.2 -86.9 -50.8
Ткип, 0С 19.5 -85.1 -66.8 -35.4
Химические свойства галогеноводородов во многом определяются энергиями связей в них. Этот вопрос подробно обсуждался в разд.4. Последовательное уменьшение прочности связи H¾Г приводит к усилению кислотных свойств: если HF - кислота средней силы, то HI - самая сильная среди галогеноводородов. И это неудивительно. Чем крупней молекула НГ, чем меньше энергия связи в ней, тем легче она поляризуется диполями воды и, в конечном итоге, распадается с образованием гидратированных ионов:


Поскольку в галогеноводородах атомы галогенов находятся в минимальной степени окисления, то данные вещества могут проявлять только восстановительные свойства. Способность реализовать эти свойства определяется стабильностью степени окисления минус один (разд.4), а, следовательно, растет от фторо- к иодоводороду. Фтороводород является настолько слабым восстановителем, что может быть окислен только в процессе электролиза. Поскольку сам фтороводород обладает слабой электропроводностью, а ионные фториды - относи-тельно высокими температурами плавления, для этих целей используют смесь KF и HF (Тпл» 700С). Для окисления хлороводорода уже могут быть использованы некоторые вещества, обладающие в кислой среде очень высокими окислительными свойствами (KMnO4, K2Cr2O7, MnO2, PbO2 и т.п.):
2KMnO4 + 10HCl ¾® 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
В свою очередь бромо- и иодоводород могут быть окислены и менее сильными окислителями. В частности, они взаимодействуют с концентрированной серной кислотой, причем, если в реакции с бромоводородом основным продуктом восстановления окислителя является SO2, то HI способен восстановить серную кислоту до S и даже H2S:
2HBr + H2SO4 (конц.)  Br2¯ + SO2 +2H2O
Br2¯ + SO2 +2H2O
8HI + H2SO4 (конц.)  H2S + I2¯ + 4H2O
H2S + I2¯ + 4H2O
Среди свойств других ковалентных молекулярных галогенидов (РГ5, СГ4 и др.) следует отметить, что энергия связи в них меняется также, как и в галогеноводородах (самыми устойчивыми являются фториды). Их общим химическим свойством является склонность к гидролизу, которая облегчается при переходе к иодидам, что однозначно коррелирует с их низкой устойчивостью. При гидролизе таких соединений образуется смесь двух кислот:
PF5 + 4H2O  H3PO4 + 5HF
H3PO4 + 5HF
SiCl4 + 3H2O  ''H2SiO3''¯ + 4HCl
''H2SiO3''¯ + 4HCl
Поэтому их называют диангидридами или галогенангидридами. Например, PCl5 - хлорангидрид ортофосфорной кислоты.
Ионные галогениды - кристаллические вещества. Их температуры плавления определяются энергиями кристаллических решеток и максимальны для фторидов (см. разд.4). Поскольку большинство ионных галогенидов (за исключением солей серебра, свинца, таллия (I) и некоторых других элементов) хорошо растворимы в воде, то реакции с их участием, как правило, выполняют в водных растворах. В этих условиях галогенид-ионы могут проявить свои восстановительные свойства (наиболее сильно они выражены у иона I-):
K2Cr2O7 + 14HBr + 6KI ¾® 3I2 + 2CrBr3 + 8KBr + 7H2O

6.3 С р а в н и т е л ь н а я х а р а к т е р и с т и к а
о д н о т и п н ы х к и с л о р о д с о д е р ж а щ и х к и с л о т
и и х с о л е й
В положительных степенях окисления галогены образуют достаточно много и кислот, и солей. Их характеристика предусматривает поиск и объяснение общих черт, а также анализ закономерностей различия важнейших свойств. Некоторые замечания по этим вопросам можно сделать уже сейчас, до более подробного разговора о соединениях, образуемых галогенами в той или иной конкретной степени окисления.
Во-первых, все положительные степени окисления для галогенов, в общем-то, мало характерны (хотя устойчивость их, конечно, разная). Поэтому их главным окислительно-восстановительным свойством, а в некоторых случаях единственным, является способность выступить в качестве окислителя (т.е. стремление понизить степень окисления атома галогена).
Второе, их получение, как правило, достаточно сложный процесс. В случае соединений хлора это, в основном, реакции диспропорционирования. Соответствующие соединения других галогенов могут быть получены, кроме того, с использованием таких сильных окислителей, как хлор (хлорная вода), HNO3(конц.).
В-третьих, устойчивость соединений одного элемента, как правило, растет с увеличением степени окисления атома галогена (за счет более эффективного p-связывания). Устойчивость же однотипных соединений, т.е. таких, в которых атомы галогенов имеют одну и ту же степень окисления, как правило, повышается при переходе от соединений хлора к соединениям иода (астата). Это предопределяется увеличением кратности связи Г¾О за счет увеличения разности электроотрицательностей атомов галогена и кислорода. В то же время, следует иметь в виду, что в реализации этих тенденций имеются некоторые исключения, приводящие к дестабилизации высшей положительной степени окисления (+7) у брома и, особенно, у астата.
И, наконец, в заключение отметим, что кислородсодержащие кислоты всегда менее устойчивы, чем соответствующие им соли. Это обусловлено высоким поляризующим действием протона на сложный анион, что приводит к понижению энергии связей в нем.
а) степень окисления +I. Энергия связей в анионах ГО- относительно невелика, и под влиянием протонов они легко разрушаются. Поэтому хлорноватистая, бромноватистая и иодноватистая кислоты в свободном виде не выделены, а существуют только в очень разбавленных растворах. Поскольку степень окисления “центрального” атома в НГО мала (+1), то кислотный характер у данных гидроксидов выражен очень плохо:
HOCl  H+ + ClO-
H+ + ClO-
причем, т.к. поляризующее действие атомов Г+1 по подгруппе уменьшается (из-за увеличения радиуса), то ослабевают и кислотные свойства. В итоге HIO оказывается уже амфотерным электролитом:
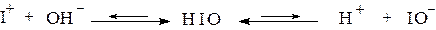
Несмотря на то, что соли более устойчивы (например гипохлорит кальция Ca(OCl)2 в смеси с хлоридом кальция CaCl2 составляют основу хлорной извести), как кислоты, так и их соли являются энергичными окислителями:
3KClO + 2K3[Cr(OH)6]  3KCl + 2K2CrO4 + 2KOH + 5H2O
3KCl + 2K2CrO4 + 2KOH + 5H2O
Причем окислительные свойства в ряду ClO- - BrO- - IO- уменьшаются. Более того, в связи с постепенной стабилизацией по подгруппе степени окисления +5 (см. разд.6.3), усиливаются восстановительные свойства данных анионов:
NaIO +H2O2  NaIO3 + 2H2O.
NaIO3 + 2H2O.
В отсутствие и восстановителей, и окислителей низкая устойчивость анионов ГО- приводит к их диспропорционированию:
3ГО-  2Г- + ГО3-
2Г- + ГО3-
(в случае гипоиодита преобладает процесс
3IО- + 2H2O  2I2 + IО3- + 2OH-).
2I2 + IО3- + 2OH-).
б ) степень окисления +III. В этом случае характер изменения свойств кислот НГО2 и их солей во многом повторяет особенности соединений в степени окисления +1. Однако, встречаются они реже из-за высокой склонности к диспропорционированию:
3ГО2-  Г- + 2ГО3-.
Г- + 2ГО3-.
в) степень окисления +V. Энергия связи в анионах ГО3-выше, чем в ГО-и в ГО2-. Поэтому кислоты типа НГО3 и соответствующие им соли (хлораты, броматы, иодаты) более устойчивы, чем аналогичные соединения галогенов в степенях окисления +1 и +3. В связи с этим уменьшаются окислительные свойства соединений галогенов +5. В то же время по подгруппе устойчивость однотипных соединений также повышается. Например, HClO3 может быть получен только в растворах с концентрацией до 40%, HBrO3 - до50%, тогда как HIO3 выделен в свободном виде. Если же еще принять во внимание, что от хлора к иоду (астату) уменьшаются все низшие потенциалы ионизации (от I1 до I5), то степень окисления +5 постепенно стабилизируется, а поэтому окислительные свойства и НГО3 и, скажем, КГО3 уменьшаются в подгруппе сверху вниз. Именно поэтому в приведенном ниже уравнении окислителем является бертолетова соль, а не иодноватая кислота (т.е. реакция идет слева направо, а не наоборот):
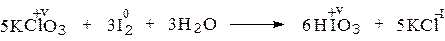
Наряду с окислительными свойствами, у соединений галогенов +5 могут наблюдаться и восстановительные свойства. В соответствие со стабилизацией высшей (+7) степени окисления в подгруппе галогенов восстановительные свойства несколько лучше выражены у соединений I (+5), чем у Cl (+5). В то же время высшая степень окисления неизвестна для астата и очень нехарактерна для брома (см. разд.5), а поэтому соединения At(+5) не могут быть окислены, а броматы проявляют восстановительные свойства только в сильно щелочной среде в реакциях с суперокислителями, типа F2:

Сила кислот в ряду HClO3 - HBrO3 - HIO3 уменьшается, причем Кд хлорноватой и бромноватой кислот близки (обе являются довольно сильными). Это обусловлено тем, что из-за 3d-сжатия радиусы атомов (и ионов Cl+V и Br+V) мало отличаются, а, следовательно, по поляризующему действию ион Br+5 лишь немного уступает Cl+V.
г) степень окисления +VII. Кислоты и, тем более, соли, образуемые галогенами в данной степени окисления более устойчивы, чем аналогичные соединения в других положительных степенях окисления. Так, например, в свободном виде существуют не только иодная кислота HIO4×2H2O (H5IO6), но и хлорная (HClO4). Но, в то же время, соединения астата (+7) не известны, а бромат-ион BrO4- крайне нестабилен и является очень сильным окислителем (особенно в кислой среде):


Это объясняется, с одной стороны, аномалиями в значениях высших потенциалов ионизации, а, с другой, - большими энергетическими затратами на вовлечение валентных s-орбиталей в атомах Br и At в sp3-гибридизацию (см. разд.5).
ПРИЛОЖЕНИЕ
Таблица 1

|
Некоторые константы атомов (ионов) галогенов
Таблица 2
Потенциалы ионизации атомов галогенов
I1 I2 I3 I4 I5 I6 I7
F 17.4 35.0 62.7 87.1 114.2 157.1 185.1
Cl 13.0 23.8 39.9 53.5 67.8 96.7 114.3
Br 11.8 21.6 35.9 47.3 59.7 88.6 103.0
I 10.5 19.1 31.4 41.7 52.1 76.8 90.2
At 9.2 Определены с низкой точностью.
1 Характер связи в нем сохранится ионным только при условии низкого поляризующего действия катиона (К+). В противном случае будет усиливаться доля ковалентного типа взаимодействия (в присутствии Н+ получаем ковалентные молекулярные галогениды).
2 Во фтороводороде кроме прочной внутримолекулярной ковалентной связи имеется довольно сильное межмолекулярное взаимодействие по типу "водородная связь".В определённом смысле оно носит донорно-акцепторный характер.
3 Способ установления водородных связей имеет определенное сходство с ковалентным донорно-акцепторным механизмом. Именно заметное участие атомных орбиталей (в данном случае атома водорода одной молекулы HF и атома фтора другой) и предопределяет высокую энергию этого взаимодействия: зачастую она на порядок превышает силы ван-дер-ваальса и составляет до 40% от энергии обычной ковалентной внутримолекулярной связи. Водородная связь может быть и внутримолекулярной, как, например, в аминокислотах, белках.
Дата добавления: 2015-09-11; просмотров: 154 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Катехизис искупительного подвига | | | Позаурочні форми навчання. Семінарські заняття |