Строение
Лекция 10. Оксокислоты галогенов.
§ 1. Характерные степени окисления .
-1
+1
+3
(+4)
+5
(+6)
+7
НГ
Г2
НОГ
НГО2
НГО3
-
НГО4
(а ) Степень окисления (СО) – формальное число электронов, которое отдает или принимает частица.
b ) Характерны нечетные СО.
(с ) Реальный заряд: КCl d 3
d = 0,7
§ 2. Получение .
2.1. Получение HFO :
2 + H2 O HOF + HF
(a) Не диссоциирует
(b) Не образует солей
(c) HOF + H2 O = H2 O2 + HF
Но: 2F2 + 2H2 O 2
2.2. (а) Cl2 + H2 O = HCl + HClO
(b) HCl + 2 HgO ® 2 HgO · HgCl2 ¯
2 + H2 O + (n + 1)HgO = 2HClO + nHgO · HgCl2 ¯
или
(а) Cl2 + H2 O = HCl + HClO
2 CO3 + 2HCl = 2NaCl + CO2 + H2 O
2Cl2 + H2 O + Na2 CO3 = 2HClO + 2NaCl + CO2
2.3. HXO3
Ba(XO3 )2 + H2 SO4 = + BaSO4 ¯
Х = Cl, Br
3I2, ТВ . + 10 HNO3 = + 10 NO2 + 2H2 O
2.4 HXO4
KClO4 + H2 SO4 HClO4 + KHSO4
NaBrO4 + H2 SO4 = HВrO4 + NaHSO4
Ba3 (H2 IO6 )2 + 3H2 SO4 = 2H5 IO6 + 3BaSO4 ¯
Строение
1. Н – О Ð НОХ = 103о
Х
2. Х ХО
Н – О Cl
Особенность HIO3
HIO3 + HIO3 ⇄ [H(IO3 )2 ]- ; K = 4,
поэтому из кислых растворов
кристаллизуются кислые соли
KH(IO3 )2 ; KH2 (IO3 )3
3.
H – O Cl
4. Иодная кислота HIO4 × 2H2 O = H5 IO6
4 + 2H2 O = H5 IO6 4 IO 3 IO
TeO 2 TeO4 · 2H2 O = H6 TeO6
H5 IO6 ® За счет водородных связей Н – О Н
октаэдры образуют трехмерный каркас.
H5 IO6 = [IO(OH)5 ] = HIO4 × 2H2 O
lektsii.net - Лекции.Нет - 2014-2025 год. (0.013 сек.)
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав

 (b) Характерны нечетные СО.
(b) Характерны нечетные СО. F2 + H2O HOF + HF
F2 + H2O HOF + HF 4HF + O2
4HF + O2 
 2Cl2 + H2O + (n + 1)HgO = 2HClO + nHgO · HgCl2 ¯
2Cl2 + H2O + (n + 1)HgO = 2HClO + nHgO · HgCl2 ¯ (b) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
(b) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O



 1. Н – О Ð НОХ = 103о
1. Н – О Ð НОХ = 103о



 2. Х ХО
2. Х ХО  - пирамида
- пирамида







 XO
XO  - тетраэдр
- тетраэдр












 IO
IO  HIO4 + 2H2O = H5IO6
HIO4 + 2H2O = H5IO6  H4IO
H4IO 
 H3IO
H3IO 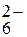
 ® H2TeO4 · 2H2O = H6TeO6
® H2TeO4 · 2H2O = H6TeO6

















