
Читайте также:
|
Факторы: а) число концевых атомов кислорода;
b) размер и электроотрицательность атомов галогенов;
с) сила оксокислот галогенов растет справа налево и сверху вниз.
СО




 +1 HOCl HOBr HOI
+1 HOCl HOBr HOI




 +5 HClO3 HBrO3 HIO3
+5 HClO3 HBrO3 HIO3
+7 HClO4 HBrO4 HIO4
(H5IO6)
Диаграммы окислительных состояний.
|
|
|
|
|
 (2) А+ + + 2е = Ао; Е; nEo = ВЭ2 = Е × 2
(2) А+ + + 2е = Ао; Е; nEo = ВЭ2 = Е × 2
(3) nEo = -DGo
Построение
 | |||
 | |||
Правила:
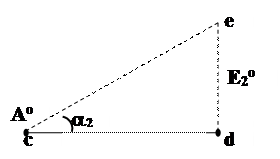
1. Наклон (tga) прямой, соединяющей ВЭ двух частиц, равен потенциалу данной пары

2. Больший наклон соответствует большему окислительному потенциалу,
т.е. tg a2 > tg a1;  , поэтому
, поэтому
 , но
, но

3.
| |||
 | |||
DG(2¢) < DG(2)
4.
 |
|
Окислительные свойства оксокислот галогенов
(а) 2KI + Cl2 = I2 + 2KCl
(b) Cl2 + H2O = HClO + HCl
(c) 3HClO = 2HCl + HClO3
(d) HClO3 + I2 = 2HIO3 + Cl2
(e) I2 + 3Cl2 = 2ICl3

Рис. 10.1. Диаграмма окислительных состояний оксокислот хлора



Рис. 10.2. Диаграмма окислительных состояний оксокислот иода

Рис. 10.3. Диаграмма окислительных состояний оксокислот хлора и иода
Дата добавления: 2015-09-11; просмотров: 87 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Строение | | | Общие замечания |