
Читайте также:
|
Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным  [сн 1] и связанным с ним магнитным моментом.
[сн 1] и связанным с ним магнитным моментом.
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
Количество протонов в ядре называется его зарядовым числом  — это число равно порядковому номеру элемента, к которому относится атом, в таблице Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом
— это число равно порядковому номеру элемента, к которому относится атом, в таблице Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом  . Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом
. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом  (
( ) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Из-за разницы в числе нейтронов 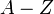 изотопы элемента имеют разную массу
изотопы элемента имеют разную массу  , которая является важной характеристикой ядра. В ядерной физике массу ядер принято измерять в атомных единицах массы (а. е. м.), за одну а. е. м. принимают 1/12 часть массы нуклида 12C[сн 2]. Следует отметить, что стандартная масса, которая обычно приводится для нуклида — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов (более точное значение получится, если учесть еще и энергию связи электронов с ядром).
, которая является важной характеристикой ядра. В ядерной физике массу ядер принято измерять в атомных единицах массы (а. е. м.), за одну а. е. м. принимают 1/12 часть массы нуклида 12C[сн 2]. Следует отметить, что стандартная масса, которая обычно приводится для нуклида — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов (более точное значение получится, если учесть еще и энергию связи электронов с ядром).
Кроме того, в ядерной физике часто используется энергетический эквивалент массы. Согласно соотношению Эйнштейна, каждому значению массы  соответствует полная энергия:
соответствует полная энергия:
 , где
, где  — скорость света в вакууме.
— скорость света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
 ,
,
а так как 1 электронвольт = 1,602176·10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен[1][3]:
 .
.
Зарядовым числом  полностью определяется химический элемент. Парой чисел
полностью определяется химический элемент. Парой чисел  и
и  (массовое число) полностью определяется нуклид. Можно рассмотреть некоторые ядерно-физические характеристики нуклидов с заданными зарядовыми и массовыми числами.
(массовое число) полностью определяется нуклид. Можно рассмотреть некоторые ядерно-физические характеристики нуклидов с заданными зарядовыми и массовыми числами.
Число протонов в ядре  определяет непосредственно его электрический заряд, у изотопов одинаковое количество протонов, но разное количество нейтронов. Ядерные свойства изотопов элемента в отличие от химических, могут различаться чрезвычайно резко[1].
определяет непосредственно его электрический заряд, у изотопов одинаковое количество протонов, но разное количество нейтронов. Ядерные свойства изотопов элемента в отличие от химических, могут различаться чрезвычайно резко[1].
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы  , изменяющейся на единицу от элемента к элементу и равной единице для водорода:
, изменяющейся на единицу от элемента к элементу и равной единице для водорода:
 , где
, где
 и
и  — постоянные.
— постоянные.
Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли.
Дата добавления: 2015-01-30; просмотров: 160 | Поможем написать вашу работу | Нарушение авторских прав |