
Читайте также:
|
Внутренняя энергия U одного моля идеального газа равна:
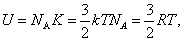 или или
|

|
Таким образом, внутренняя энергия зависит только от температуры. Внутренняя энергия U является функцией состояния системы, независимо от предыстории.
Понятно, что в общем случае термодинамическая система может обладать как внутренней, так и механической энергией, и разные системы могут обмениваться этими видами энергии.
теплота - это форма беспорядочного (теплового) движения образующих тело частиц (молекул, атомов, электронов, фотонов и т. д.). Количество теплоты есть количествоэнергии, получаемой или отдаваемой системой при теплообмене. Наряду с работой количество теплоты является мерой изменения внутренней энергии. При теплообмене внутренняя энергия системы меняется в результате прямых взаимодействий (соударений) молекул системы с молекулами окружающих тел.
Элементарное количество сообщаемой телу теплоты (ΔQ) равно произведению теплоемкости тела (с) на соответствующее малое изменение температуры (ΔT):
ΔQ = с х ΔТ
РАБО́ТА, в термодинамике:
1) одна из форм обмена энергией (наряду с теплотой) термодинамической системы (физического тела) с окружающими телами;
2) количественная характеристика преобразования энергии в физических процессах, зависит от вида процесса; работа системы положительна, если она отдает энергию, и отрицательна, если получает.
РАВНОВЕСНЫЙ ПРОЦЕСС
(квазистатический процесс) в термодинамике, процесс перехода термодинамич. системы из одного равновесного состояния в другое, столь медленный, что все промежуточные состояния можно рассматривать как равновесные, т. е. характеризующиеся очень медленным (в пределе — бесконечно медленным) изменением термодинамич. параметров состояния. Р. п.— одно из осн. понятий термодинамики равновесных процессов. Всякий Р. п. явл. обратимым процессом и, наоборот, любой обратимый процесс явл. равновесным.
Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний.
Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений.
Реальные процессы изменения состояния системы всегда происходят с конечной скоростью, поэтому не могут быть равновесными. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому равновесные процессы называют квазистатическими.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура,давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия. На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией. Иными словами, термодинамическое равновесие достигается, если скорость релаксационных процессов достаточно велика (как правило, это характерно для высокотемпературных процессов) либо велико время для достижения равновесия (этот случай имеет место в геологических процессах).
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
1. равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы — локальное равновесие,
2. неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе — частичное равновесие,
3. имеют место как локальное, так и частичное равновесие.
Дата добавления: 2015-01-30; просмотров: 199 | Поможем написать вашу работу | Нарушение авторских прав |