
Читайте также:
|
Зависимость константы скорости k температуры Т описывается основным уравнением химической кинетики (уравнением Аррениуса)
k = k0 ∙e-E∕RT, (9)
где k0 – предэкспоненциальный множитель;
е – основание натурального логарифма;
Е – энергия активации;
R – универсальная газовая постоянная.
В малом интервале температур (до 200 К) величины k0 и Е изменяются незначительно и их можно считать постоянными. Это допущение дает возможность определить их значения графически. После логарифмирования уравнения (9)
 . (10)
. (10)
Видно, что в координатах  график этой функции представляет собой прямую, тангенс угла наклона которой есть отношение Е ∕ R, т.е
график этой функции представляет собой прямую, тангенс угла наклона которой есть отношение Е ∕ R, т.е
 . (11)
. (11)
Для построения графика сведем ранее определенные данные в табл.4.
Таблица 4
Значения константы скорости ki при различных температурах Тi
| Тi, К | ||||
ki, 
| 0,0087 | 0,00628 | 0,0052 | 0,004 |

| 2,481 | 2,525 | 2,564 | 2,584 |
| -Inki | 4,529 | 5,07 | 5,26 | 5,52 |
По данным табл.4 построена зависимость, представленная на рис.4.

Рис.4. Зависимость логарифма константы скорости от обратной температуры
Из рис.4 определяем тангенс наклона:

и затем из уравнения (11) энергию активации
 Дж ∕моль.
Дж ∕моль.
Значение предэкспоненциального множителя найдем из уравнения (10), подставив в него любую пару значений Ink и  , взятых из рис.4.
, взятых из рис.4.
Например, при  = 2,55∙10-3; Ink = -5,2.
= 2,55∙10-3; Ink = -5,2.
Тогда 
Откуда 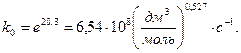
Итак, все постоянные в уравнениях (9),(10) известны. Находим k5 при Т5 = 440К.


Используя выражение (8) рассчитаем время, за которое 23% исходных веществ превратятся в продукты реакции, т.е. их концентрация изменится от значения
С0 = 1,00моль∕дм3 до значения С = 0,77С0моль ∕дм3 при температуре 440 К.

Таким образом, при температуре 440К, при исходных концентрациях реагирующих веществ  моль ∕дм3 23% исходных веществ прореагирует за 31,6с
моль ∕дм3 23% исходных веществ прореагирует за 31,6с
Дата добавления: 2015-04-11; просмотров: 96 | Поможем написать вашу работу | Нарушение авторских прав |