
|
Читайте также: |
Амінокислота — органічна сполука, молекули якої одночасно містять аміно- (-NH2) та карбоксильну (-СООН) групи. Амінокислоти є мономерними одиницями білків, у складі яких залишки амінокислот з'єднані пептидними зв'язками. Більшість білків побудовані із комбінації дев'ятнадцяти «первинних» амінокислот, тобто таких, що містять первинну аміногрупу, і однієї «вторинної» амінокислоти або імінокислоти (містить вторинну аміногрупу) проліну, що кодуються генетичним кодом. Їх називають стандартними або протеїногенними амінокислотами. Крім стандартних в живих організмах зустрічаються інші амінокислоти, які можуть входити до складу білків або виконувати інші функції.У залежності від того, до якого атому вуглецю приєднана аміно- група, амінокислоти поділяються на α-, β-, γ- і тощо. α-атомом вважається той атом карбону, до якого приєднана карбоксильна група, якщо біля нього ж розташована й аміногрупа, така амінокислота називається α-амінокислотою. Якщо аміногрупа приєднана до наступного (β) атома карбону, це буде β-амінокислота і так далі. Всі протеїногенні амінокислоти є α-амінокислотами. Білки всіх організмів побудовані з одного й того самого набору 20 амінокислот. Разом з тим, у складі різних видів організмів налічується десятки тисяч різних білків, кожний з яких має певну структурну й функціональну організацію та біологічні властивості. Амінокислоти — це абетка білкової молекули, і як з певної кількості літер можна створити безліч слів, так і з амінокислот у природі побудована велика кількість різноманітних білків. Кожна білкова молекула має певну будову, яка визначається послідовністю розташування амінокислот у поліпептидних ланцюгах, характерним розміщенням цих ланцюгів у просторі, здатністю створювати молекулярні структури у вигляді глобул або фібрил. Гліци́н — одна із двадцяти амінокислот, які входять до складу білків. У мРНК кодується триплетами нуклеотидів: GGU, GGC, GGA, GGG. Оскільки, на відміну від інших протеїногенних амінокислот, бічної групи в гліцину немає він не проявляє оптичної активності. Назва гліцин походить від грецького glycos — солодкий.Входить в склад багатьох, особливо фібрилярних білків; бере участь у біосинтезі глутатнону,серину, холіну, пуринових основ, креатину.

Аланін — замінна амінокислота, що є важливим джерелом енергії для різних органів, зміцнює імунну систему шляхом участі в обміні цукрів та органічних кислот.[1] L-ізомер цієї кислоти входить до складу білків.Неполярна амінокислота. Аланін- друга (після лейцину) по розповсюдженості амніокислота, яка часто входить в спіральні фрагменти білків. Кодується чотирьма кодонами (GCU, GCC, GCA та GCG). Найпростіша з оптично активних амінокислот.

Лейци́н — одна з двадцяти амінокислот, що входять до складу білків живих організмів.

Ізолейцин — одна з амінокислот, L-ізомер якої входить до складу білків. Неполярна амінокислота. Кодується трьма кодонами (AUU, AUC та AUA). Ізолейцин — незамінна амінокислота (не синтезується в організмі людини).

Аргіні́н (δ-гуанідин-α-аміновалеріанова кислота, скорочення Арг, Arg, R) — основна α-амінокислота, l-форма якої входить до 20 амінокислот, що кодуються генетичним кодом (кодони ЦГА, ЦГУ, ЦГГ, ЦГЦ, АГА та АГГ в мРНК[1]) і становлять основу білків. Для людини аргінін є напівнезамінною амінокислотою, тобто біохімічні шляхи для її біосинтезу існують, проте в певні періоди життя, зокрема інтенсивного росту та розвитку, а також під час деяких захворювань вони не можуть забезпечувати достатньої кількості цієї сполуки, через що вона повинна потрапляти в організм із їжею[2]. Для деяких видів тварин, таких як птахи, хижі та морські ссавці, аргінін є незамінною амінокислотою[3].Завдяки гуанідиновому угрупуванню є найосновнішою з амінокислот. Часто входить до частин білків, що взаємодіють з ДНК. У організмі тварин деградується до сечовини.
Окрім того, що аргінін входить до складу білків, ця амінокислота також важлива для багатьох інших метаболічних шляхів клітини, зокрема синтезу Нітроген (II) оксиду, поліамінів, проліну, глутамату, креатину та агматину[4].

Аспарагі́н (прийняті скорочення: Асн, Asn, N) — амід аспарагінової кислоти (2-аміно-бутанамід-4-ова кислота), одна із двадцяти амінокислот, що входять до складу білків. У мРНК аспарагін кодується триплетами нуклеотидів AAU і AAC. Ця амінокислота бере участь у синтезі сечовини й піримідинових основ і переамінуванні амінокислот.[1]Із двадцяти амінокислот, що кодуються генетичним кодом, аспарагін був відкритий першим у 1806 році. Його назва походить від слова asparagus, оскільки його виділили із спаржі (Asparagus officinalis)[2].Аспарагін не є незамінною амінокислотою для людини, він може бути синтезований із глутаміну у реакції, каталізованій ферментом аспарагінсинтазою. Проте, рівень цього ферменту дуже низький у клітинах гострої лімфобластної лейкемії, через що вони є ауксотрофними за аспрагіном. Це дозволяє використовувати фермент аспарагіназу, що розщеплює аспарагін у сироватці крові до аспарагінової кислоти і аміаку, для знешкодження цих клітин. Така терапія госторої лімфобластної лейкемії успішно використовується вже близько 40 років[3].

Аспарагі́нова кислота́ (аспартова, аміноянтарна кислота) COOHCH2CHNH2COOH — амінокислота, один з проміжних продуктів азотистого обміну у тварин і рослин. Амід аспарагінової кислоти аспарагін є важливим продуктом азотистого обміну у рослин, резервом азоту; знешкоджує аміак, що утворюється в процесі перетворення білків.Аспарагінова кислота стимулює синтез білка, знижує рівень аміаку в крові, нормалізує роботу печінки.

Валін - одна з двадцяти стандартних амінокислот у складі білків

Гістидин — одна з двадцяти стандартних амінокислот, що входять до складу білків.З гістидину в організмі синтезується нейромедіатор гістамін, що є сигнальною сполукою в алергічних процесах.

Глутамі́нова кислота́ (α-аміноглутарова кислота; Glu, E) — аліфатична α-амінокислота. Зустрічається у всіх організмах у вільному вигляді (в плазмі крові разом з глутаміном складає близько 1/3 всіх вільних амінокислот) та у складі білків. Була вперше виявлена у глютені пшениці, через що і отримала свою назву.
Глутамінова кислота (харчова добавка E620) та її солі (глутамат натрію Е621, глутамат калію Е622, диглутамат кальцію Е623, глутамат амонію Е624, глутамат магнію Е625) використовуються як підсилювачі смаку в багатьох харчових концентратах і консервах.

Глутамін 
Лізин — амінокислота, що входить до складу білків. Завдяки наявності ω-аміногрупи має позитивний заряд у нейтральних розчинах. Лізин належить до незамінних амінокислот, багатоклітинними тваринами не синтезується. Відомі два основні шляхи біосинтезу лізину: через α-аміноадипінову кислоту (т.зв. ААА-шлях) та через диамінопімелінову кислоту (ДАП-шлях, рослини).Доведено її імуномоделюючу та противірусну, антидепресантну й анксіолітичну дії.

Метіонін — незамінна амінокислота, що входить до складу ферментів та майже всіх тканин. Добре впливає на стан нирок, знижує токсичність багатьох отруйних речовин і сприяє відновленню функцій печінки, сприяє створенню неорганічної сірки у організмі. Спричиняє прискорення росту.

Пролін 
Тирозин (скорочення: Тир, Tyr, Y) — одна з двадцяти амінокислот, що входять до складу білків. Ароматична альфа-амінокислота. Назва тирозин походить від грецького tyros, що означає сир, оскільки саме у сирі було вперше виявлено цю амінокислоту. Тирозин існує в двох оптично ізомерних формах — L і D і у вигляді рацемату (DL), білки містять тільки L-форму. За будовою відрізняється від фенілаланіну наявністю фенольної гідроксильної групи в пара-положенні бензольного кільця. Відомі також мета-і орто-ізомери тирозину, які не мають біологічного значення.Тирозин входить до складу активних центрів деяких ферментів. Також залишки цієї амінокислоти в білках можуть бути субстратами для ферментів, що здійснюють посттрансляційну модифікацію, наприклад протеїнкіназ. Окисна конденсація залишків тирозину з утворенням ди- і тритирозину використовується для формування молекулярних зшивок між деякими білками (наприклад резилін комах).
Нітрування залишків тирозину, а також фенілаланіну, триптофану і гістидину, лежить в основі ксантопротеїнової якісної реакції на білки.

Треоні́н (α-аміно-β-гідроксимасляна кислота) — гідроксиамінокислота, одна з двадцяти стандарних амінокислот. Використовується як для людини, так і для тварин.Це незамінна амінокислота. Як кормова добавка використовується у раціонах багатьох тварин, для виробництва кормів, у свинарстві. Підтримує у організмі білковий обмін. Бере участь у обміні жирів, коллагену і еластину. Стимулює імунітет, сприяє утворенню антитіл, регулює засвоєння кормів. Треонін впливає на ріст м'язів скелету, синтез імунних білків, травних ферментів, гліцерину.У раціонах на основі зернових треонін знаходиться в дуже малій кількості і є другою лімітуючою амінокислотою, після лізину. Щоб збагатити корм, використовують кристалічний треонін. Введення L-Треоніну покращує якість м'яса і зменшує витрати корму та забезпечує досягнення високих приростів. Див.: L-Треонін кормовий

Триптофа́н (β-(β-індоліл)-α-амінопропіонова кислота[1]) — незамінна амінокислота. Кодується тільки одним кодоном — UGG. L-стереоізомер входить до складу гамаглобулінів, фібриногену, казеїну та інших білків. Триптофан є провітаміном.
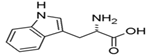
Фенілаланін — амінокислота, одна з двадцяти стандартних амінокислот, що входять до складу білків. Ліпофільна (аполярна) амінокислота. Поглинає ультрафіолет (254 нм) і має слабку флуоресценцію.

Цистеї́н — одна з амінокислот, L-ізомер якої входить до складу білків. Надзвичайно важливий для формування третинної структури білків завдяки здатності утворювати дисульфідні містки й фіксувати наближеними у просторі ділянки протеїну віддалені по послідовності. Позначення: Cys, C.

Дата добавления: 2015-09-11; просмотров: 124 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Гормони,похідні амінокислот(фенілаланіну,трозину,триптофану,гістиу).Місце їх синтезу та біологічна роль. | | | Вітамін В11.. |