
Читайте также:
|
Для химической реакции, написанной в общем виде:
a A + b B = r R + s S
изменение энтальпии равно
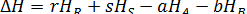
Скорость изменения Δ H с температурой получается при дифференцировании последнего уравнения по температуре при постоянном давлении:
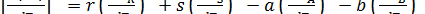 [4.9]
[4.9]
Поскольку 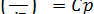 , то следовательно получаем
, то следовательно получаем
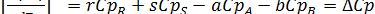 [4.10]
[4.10]
Это уравнение можно объяснить следующим образом:
- изменение энтальпии реакции при постоянном давлении и повышении температуры на один градус равно сумме теплоемкостей продуктов реакции (каждая из которых умножена на стехиометрический коэффициент) минус сумма теплоемкостей исходных веществ (также умноженных на стехиометрические коэффициенты).
Уравнение (4.10) можно проинтегрировать от Т1 до Т2 для получения соотношения между Δ H при этих двух температурах:
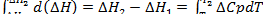 [4.11]
[4.11]
Если известны значение Δ H реакции при одной температуре, значения Ср реагирующих веществ и продуктов реакции для некоторого температурного интервала, то, пользуясь полученным уравнением, можно рассчитать Δ H для другой температуры. С этой целью полезно применить эмпирическую зависимость Ср от абсолютной температуры.
Пример 13.
Рассчитать теплоту сгорания водорода при 1500°К:
2Н2(г) + О2(г) = 2Н2О(г) ΔH = - 115595,8 кал (484,0 кДж)
Коэффициенты для расчета мольных теплоемкостей возьмем из таблицы и подставим в уравнение

Получаем

или 501,1 кДж
Уравнение (4.11) применимо лишь в том случае, если при переходе от Т1 к Т2 не происходит фазовых превращений. Для учета изменений энтальпии, сопровождающих фазовые превращения (плавление, испарение), необходимо вводить в уравнение добавочные члены.
Термохимические расчеты применяются при составлении теплового баланса химико-технологических процессов и, в частности, при тепловых расчетах химических реакторов.
Дата добавления: 2014-12-15; просмотров: 165 | Поможем написать вашу работу | Нарушение авторских прав |