
Читайте также:
|
Чтобы понять природу электрохимических процессов, обратимся к рассмотрению нескольких достаточно простых ситуаций. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы.
Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец, наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, которое можно выразить уравнением:

или с учетом гидратации ионов в растворе:

Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления.
При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом Ле Шателье смещается влево и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде.
Равновесие можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионовиз раствора.
При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы.
У изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл - раствор. Такие пары называют полуэлементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С.
Ряд стандартных электродных потенциалов. Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25 °С, и характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е°.
Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-”, а знак “+” имеют стандартные потенциалы электродов, являющихся окислителями.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов: Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напряжений характеризует химические свойства металлов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в электрохимическом ряду напряжений металлов после него.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т. е. находящиеся в электрохимическом ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Как и в случае определения значения Е° металлов, значения Е° неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция?
Количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
Электролиз растворов. Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F-, SO42- , NО3-, РО43- , а также растворов щелочей выделяется кислород; б) при окислении анионов Сl-, Вr-, I- выделяются соответственно хлор, бром, иод; в) при окислении анионов органических кислот происходит процесс:
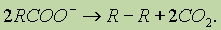
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al+ и Н+, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Си2+ и 2Сl-, которые под действием электрического тока направляются к соответствующим электродам:

На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl- и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так:
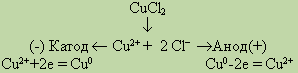
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Электролиз расплавов. Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов:

Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород,а нааноде — кислород, и электролиз сводится к электролитическому разложению воды.
Электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах.
Закон электролиза Фарадея. Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:

где т — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); п — количество отдаваемых или принимаемых электронов; I — сила тока(А); t — продолжительность процесса(с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 Кл/моль = 26,8 А×ч/моль).
Экспериментальная часть.
Опыт №1.
В пробирку с 5-6каплями раствора серной кислоты (Сэк=2) опустите маленький кусочек цинка. Напишите уравнение реакции. Какой ион выполняет функцию окислителя.
Молекулярная схема
H2SO4(р)+Zn(к) ZnSO4(р)+H2(г)
Ионная схема
H+12S+6O-24+Zn0 H02 +Zn+2S+6O-24
Окислитель восстановитель
Полуреакции окисления и восстановления
2H++2e- H02 2 восстанавливается
Окислитель 2(стехиометрический коэффициент)
Zn0-2e- Zn+2 2 окисляется
Восстановитель
Уравнение в молекулярной форме
H2SO4+Zn H2 +ZnSO4
При протекании реакции происходит выделение газа(водорода). Осадок не выпадает. Окраска раствора не происходит.
Е0=0+0.76=0.76(В)
∆rG0=-2*96500*0.76=146680(Дж/моль)
Мэк(H2SO4,восстановитель)=M(H2SO4)/2=49г/моль
Мэк(Zn,окислитель)=М(Zn)/2=32.5г/моль
Опыт 12.
В пробирку с 3-4каплями раствора нитрата калия (Сэк=2) прибавьте 2-3капли раствора серной кислоты (Сэк=2). Наблюдайте выделение бурого газа. Реакция протекает в три стадии.
Молекулярная схема
KNO2+H2SO4 HNO2+KHSO4
HNO2 HNO3+NO+H2O
NO+O2 NO2
Ионная схема
K+1N+3O-22+H+12S+6O-24 H+1N+3O-22+K+1H+1S+6O-24
H+1N+3O-22 H+1N+5O-23+N+2O-2+H2O
N+2O-2 +O02 N+4O-22
восстановитель окислитель
Из этого следует, что окислительно-восстановительными реакциями являются 2 и 3.
Полуреакции окисления-восстановления
N+2-2e- N+4 2 2 окисляется
Восстановитель 4
O02+4e- O-22 4 1 восстанавливается
Окислитель
N+3-2e- N+5 2 1 окисляется
Восстановитель 2
N+3+1e- N+2 1 2 восстанавливается
Окислитель
Уравнения в молекулярной форме
KNO2+H2SO4 HNO2+KHSO4
3HNO2 HNO3+2NO+H2O
2NO+O2 2NO2
При протекании реакции выделяется бурый газ. Раствор цвета не меняет.
Мэк(HNO2,восстановителя)=М(HNO2)/2=23г/моль
Мэк(HNO2,окислителя)=М(HNO2)/1=46г/моль
Мэк(NO,восстановителя)=М(NO)/2=15г/моль
Мэк(O2,окислитель)=М(O2)/4=8г/моль
Вывод: В данной лабораторной работе вычислил стехиометрический коэффициент, определил ЭДС, рассчитал энергию Гиббса, вычислил молярные массы эквивалентов.
Дата добавления: 2014-12-15; просмотров: 127 | Поможем написать вашу работу | Нарушение авторских прав |