
Читайте также:
|
· 1 тип - холерик - "желчный" тип, сильные неуравновешенные нервные процессы, агрессивный тип;
· 2 тип - меланхолик - "черная желчь", слабые нервные процессы, преобладание торможения, унылый тип;
· 3 тип - сангвиник - "кровь", сильные уравновешенные подвижные нервные процессы, веселы, сильны, очень важна смена обстановки;
· 4 тип - флегматик - "лимфа", сильные уравновешенные малоподвижные нервные процессы, сильные, активны, трудолюбивы, терпеливы.
·
По выраженности сигнальных систем выделяют 4 типа:
Вопрос № 2.
Гемоглобин, его строение и функции. Виды гемоглобина. Соединения гемоглобина.
Гемоглоби́ (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложный железосодержащий белок животных, обладающих кровообращением,, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++), обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—160 г/л (нижний предел — 120, верхний предел —180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцамснижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.
Молекула гемоглобина состоит из 4 субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом.
Функции гемоглобина.
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз), чем кислород, образуя карбоксигемоглобин(HbCO). Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см.Метгемоглобинемия
). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.Строение гемоглобина.
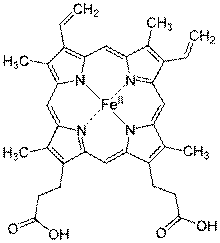
Гем – простетическая группа гемоглобина.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологическоготетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (От N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Виды гемоглобина.
Эмбрионы содержат примитивный гемоглобин (НвР)., на смену ему приходит плодовый или фетальный гемоглобин (НвF). Основным гемоглобином взрослого организма является НвА1 (98-100%) и НвА2 (до 2%), а также разновидность Нв - мышечный миоглобин.
Виды Нв отличаются друг от друга по степени химического сродства к О2. Так, НвF в физиологических условиях имеет более высокое сродство к О2, чем НвА. Эта важнейшая особенность НвF создает оптимальные условия для транспорта О2кровью плода.
Соединения гемоглобина.
К основным соединениям гемоглобина относятся: ННв - восстановленный гемоглобин и НвСО2 - соединение с углекислым газом (карбогемоглобин). Они в основном находятся в венозной крови и придают ей темно-вишневый цвет. Можно более точно определить присутствие в растворе ННв (дезоксиформа) методом спектрального анализа. Спектр ННв имеет одну широкую полосу поглощения в желто-зеленой части.
НвО2 - оксигемоглобин – находится, в основном, в артериальной крови, придавая ей алый цвет. По данным спектрального анализа известно, что спектр НвО2 имеет две узкие полосы поглощения в желто-зеленой части спектра. НвО2 - чрезвычайно нестойкое соединение, его концентрация определяется парциальным давлением О2 (рО2): чем больше рО2, тем больше образуется НвО2 и наоборот. Все вышеперечисленные соединения гемоглобина относятся к физиологическим.
Однако, есть и патологические формы гемоглобина.
Карбоксигемоглобин (НвСО) - очень прочное соединение с угарным газом, обусловленное химическими свойствами угарного газа по отношению к Нв. Оказалось, что его родство к Нв в 400-500 раз больше, чем сродство О2 к Нв. Поэтому при незначительном повышении концентрации СО в окружающей среде образуется очень большое количество НвСО. Если в организме находится много НвСО, то возникает кислородное голодание. Фактически О2 в крови очень много, а клетки тканей его не получают, т.к. НвСО - прочное соединение с О2. При спектральном определении НвСО спектр НвСО имеет аналогичные характеристики с НвО2, т. е. две узкие полосы поглощения в желто-зеленой части спектра. В растворе НвСО имеет алую окраску.
Дата добавления: 2014-12-15; просмотров: 109 | Поможем написать вашу работу | Нарушение авторских прав |