
Читайте также:
|
1. В системе CO2(г) + С(т) ↔ 2CO(г) равновесие установилось при ΔH = +110.5кДж/моль. В какую сторону сместится равновесие при понижении температуры?
А Вправо
В Влево
С Не сместится
2. В какую сторону сместится химическое равновесие в системе
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(ж) при повышении давления?
А Вправо
В Влево
С Не сместится
3. В системе 2CO2(г) ↔ 2CO(г) + O2(г) равновесие установилось при ΔH = +567,8кДж/моль. В какую сторону сместится равновесие при понижении температуры?
А Вправо
В Влево
С Не сместится
4. В системе H2 + Cl2 ↔ 2HCl равновесие установилось при ΔH = -91,8кДж/моль. В какую сторону сместится равновесие при понижении температуры?
А Вправо
В Влево
С Не сместится
5. В какую сторону сместится химическое равновесие в системе
2SO2(г) + O2(г) ↔ 2SO3(г) при понижении давления?
А Вправо
В Влево
С Не сместится
6. В какую сторону сместится химическое равновесие в системе
Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г) при повышении давления?
А Вправо
В Влево
С Не сместится
7. В какую сторону сместится химическое равновесие в системе при понижении давления
CH4(г) + 2H2O(г) = CO2(г) + 4H2(г)
А Вправо
В Влево
С Не сместится
8. В системе H2 + I2 = 2HI равновесие установилось при H = -51.8кДж. В какую сторону сместится равновесие при повышении температуры?
А Вправо
В Влево
С Не сместится
9. В системе 2SO2(г) + O2(г) ↔ 2SO3(г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования SO2.
А Увеличением концентрации О2
В Понижением температуры
С Повышением температуры
D Повышением давления
10. В системе СаСО3 (тв) ↔ СаО (тв) + СO2 (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СаО.
А Увеличением концентрации СО2
В Понижением температуры
С Повышением температуры
D Повышением давления
11. В системе СO2 (г) + С (тв) ↔ СO (г) + Н2 (г) ΔН > 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования СО.
А Увеличением концентрации СО2
В Понижением температуры
С Уменьшением массы С
D Повышением давления
12. В системе 2 HI (г) ↔ I2 (г) + Н2 (г) ΔН < 0 установилось равновесие. Изменением какого параметра можно сместить равновесие в сторону образования HI.
А Повышением температуры
В Понижением температуры
С Увеличением концентрации HI
D Повышением давления
13. При каком значении Кр обратимые реакции проходят с наиболее полным превращением исходных веществ в продукты
А Кр = 1
В Кр < 1
С Кр > 1
D Кр = 0
14. Какая из записей константы химического равновесия будет верной для реакции:
СО (г) + 2 Н2 (г) ↔ СН3ОН (г)
А 
В 
С 
D 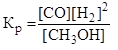
15. Какая из записей константы химического равновесия будет верной для реакции:
С (тв) + Н2О (г) ↔ СО (г) + Н2 (г)
А 
В 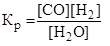
С 
D 
16. Какая из записей константы химического равновесия будет верной для реакции:
2 PbS (тв) + 3 О2 (г) ↔ 2 PbО (тв) + 2 SO2 (г)
А 
В 
С 
D 
Дата добавления: 2015-02-16; просмотров: 154 | Поможем написать вашу работу | Нарушение авторских прав |