
|
Читайте также: |
Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение: Согласно законам Фарадея:
m = ЭIt /96500, (1)
где т – масса вещества, окисленного или восстановленного на электроде; Э – эквивалентная масса вещества; I – сила тока, A; t – продолжительность электролиза, с. Эквивалентная масса меди в CuSO4 равна 63,54:2 = 31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4A, t = 60 • 60 = 3600 с, получим:

Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 1 1,742 г металла.
Решение: Из формулы (1):
Э = 11,742 • 96 500/3880 = 29,35 г/моль
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение: Из формулы (1):
I = т • 96500/ Эt.
Так как дан объем водорода, то отношение т/Э заменяем отношением 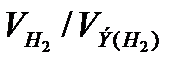 , где
, где  – объем водорода, л;
– объем водорода, л;  – эквивалентный объем водорода, л. Тогда:
– эквивалентный объем водорода, л. Тогда:
 .
.
Эквивалентный объем водорода при н.у. равен половине молярного объема 22,4/2 =11,2 л. Подставив в приведенную формулу значения  л,
л,  л, t = 6025 (1 ч 40 мин 25 с = 6025 с), находим:
л, t = 6025 (1 ч 40 мин 25 с = 6025 с), находим:
I = 1,4 • 96 500/11,2 • 6025 = 2 А.
Пример 4. Какая масса гидроксида калин образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение: Эквивалентный объем кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 • 2 = 112,22 г (56,11 г/ моль – мольная и эквивалентная масса КОН).
Пример 5. При электролизе расплава 8 г некоторого вещества на аноде выделилось 11,2 л водорода (н. у.). Что это было за вещество? Можно ли провести электролиз его водного раствора?
Решение: Выделившийся на аноде водород содержался в веществе в виде Н-. Значит, анализу подвергли гидрид: 2Н- - 2e = Н2o. Водород объемом 11,2 л (н. у.) имеет массу 1 г, т. е. на 1 г водорода в гидриде приходится 7 г металла. Отсюда атомная масса металла 7 п, где п - количество атомов водорода в гидриде. Существует 3 элемента с массой, кратной 7: Li, Si, Fe. Кремний (n = 4) отпадает, поскольку SiH4 не проводит электрический ток, а степень окисления 8 (п= 8, М=56 г/моль) у железа в данном случае весьма маловероятна. Следовательно, был взят гидрид лития LiH. Электролиз водного раствора LiH провести не удается из-за полного разложения последнего водой:
LiH + H2O  LiOH + H2
LiOH + H2  .
.
Пример 6. Рассмотрим электролиз раствора ацетата калия (подобные реакции включались в задания С3 некоторых вариантов ЕГЭ-2008):
K(-) (K+) - не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH- | 2
А(+) 2CH3COO--2ē = CH3-CH3 + 2CO2 | 2
Суммарное уравнение:
2CH3COO- + 2H2O = H2+ 2OH- + CH3-CH3 + 2CO2
Или 2CH3COOK + 2H2O = H2+ 2KOH + CH3-CH3 + 2CO2
Дата добавления: 2015-09-10; просмотров: 256 | Поможем написать вашу работу | Нарушение авторских прав |