
Читайте также:
|
Понятие об электродных потенциалах. Электродным потенциалом называют скачок потенциала, возникающий на границе «металл-раствор» электролита. На границе «металл-раствор» существует подвижное равновесие, которое можно выразить уравнением
М ⇄ Мn+ + n e⁻ (9).
Ионы металла гидратируются (10), и суммарное равновесие можно представить
Мn⁺ + m H₂O ⇄ Мn⁺(H₂O)m; (10)
М + m H₂O ⇄ Мn⁺(H₂O)m + n e⁻. (11)
Переход ионов металла в раствор сопровождается потерей электронов атомами металла, т.е. является процессом окисления. Обратный процесс – превращения гидратированных ионов металла в атомы – процесс восстановления.
Состояние равновесия (11) зависит от величины энергии ионизации атома и концентрации его ионов в растворе. Если концентрация ионов в растворе меньше равновесной, то при погружении металла в раствор равновесие (11) смещается вправо, ионы металла переходят в раствор, электроны же остаются на поверхности металла, обуславливая его отрицательный заряд по отношению к раствору. По мере дальнейшего перехода ионов металла в раствор отрицательный заряд на поверхности металла увеличивается.
Увеличивается и скачок потенциала на границе металл – раствор электролита, пока не устанавливается равновесие (11) с соответствующим ему потенциалом.
Для неактивных металлов равновесная концентрация [Мn+] в растворе очень мала. Если такой металл погрузить в раствор его соли с концентрацией ионов большей, чем равновесная (11), то наблюдается обратный процесс перехода ионов из раствора в металл. В этом случае поверхность металла получит положительный заряд, а раствор – отрицательный за счет анионов, остающихся в растворе.
Равновесию реакции окисления-восстановления (11) отвечает потенциал Ем, называемый электродным потенциалом (ЭП). Значение Ем количественно характеризует способность металла отдавать электроны, т.е. его восстановленные свойства.
Ем зависит от свойств металла, концентрации ионов и температуры, измеряется в вольтах. Эта зависимость выражается формулой Нернста
Ем = Е0м + 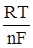 · ln[Mn+(Н2O)m], (12)
· ln[Mn+(Н2O)m], (12)
где Ем0 – стандартный потенциал при [Мn+(Н₂O)m] = 1, в вольтах (в) (приложение 3);
R – универсальная газовая постоянная 8,3144 Дж/(моль × К);
T – температура абсолютная, ⁰K;
n – зарядность иона металла;
F – константа Фарадея (96478 K);
Если в формулу (12) подставим значения R, F и Т (25°С) и заменим натуральный логарифм десятичным, то получим
Ем = Ем° +  lg [ Мn+(H₂О)m.
lg [ Мn+(H₂О)m.
Так как методов прямого измерения электродных потенциалов не существует, обычно определяют относительные электродные потенциалы. С этой целью измеряют ЭДС гальванического элемента, составленного из стандартного водородного электрода, ЭП которого условно принимают за нуль, и электрода исследуемого металла.
Гальванический элемент. Гальванический элемент – это химический источник электрической энергии, которая получается за счёт окислительно-восстановительного процесса. При этом реакция окисления происходит на одном электроде (аноде), а реакция восстановления – на другом (катоде). Роль анода играет металл с более низким значением электродного потенциала (Еа<Ек).
Соединив с водородным электродом в гальванический элемент другой полуэлемент, можно определить ЭДС, а по ней – относительный стандартный потенциал данной пары.
ЭДС (ЕD) гальванического элемента равна разности электродных потенциалов катода и анода:
ЕD = ЕК - ЕА.
Дата добавления: 2015-09-10; просмотров: 143 | Поможем написать вашу работу | Нарушение авторских прав |