
Читайте также:
|
Большая часть структурных нарушений в ДНК устраняется вырезанием (этот тип репарации специалисты называют эксцизионной; по-англ. excision repair), которое осуществляют ферменты нуклеазы. Бракованное основание удаляется в одиночку или вместе с окружением - участками цепи в 2-10 нуклеотидов. Так вырезаются модифицированные и поврежденные основания, апуриновые сайты и места с одноцепочечными разрывами. (Данная разновидность названа эксцизионной репарацией основания; base excision repair, BER.) В случае более крупных неисправностей - возникновения пиримидиновых димеров или других объемных образований в ДНК, нарушающих структуру спирали, - клеточные ножницы отстригают испорченную часть в составе куска длиной в 30 нуклеотидов. (Это уже эксцизионная репарация нуклеотида, nucleotide excision repair, NER.)
| Обобщенная схема восстановления нормальной структуры ДНК. Дефектным может быть одиночное основание, и тогда вырезается только нуклеотид; в случае более объемного повреждения из цепи удаляются и соседние с ним нуклеотиды, а образовавшуюся брешь застраивают полимеразы - или самостоятельно, или в присутствии белка-помощника (PCNA). | 
|
Каков будет размер вырезаемого куска, а значит, и заплаты, зависит от самого повреждения и соотношения имеющихся в клетке ДНК-полимераз. Эти ферменты застраивают бреши, образовавшиеся после вырезания аномального участка, используя в качестве матрицы фрагмент противоположной цепи ДНК. ДНК-полимеразы (у эукариот их известно более 15) различаются по ряду признаков, в том числе по количеству нуклеотидов, которые они успевают встроить в растущую цепь за один акт связывания с дуплексом ДНК. Полимеразы b и l присоединяют всего один нуклеотид, т.е. накладывают маленькую заплатку (short patch путь BER, как говорят специалисты). Две другие ДНК-полимеразы - d и e - способны создать большую вставку, но для этого им нужен специальный помощник - белок PCNA (proliferating cell nuclear antigen). Особенно зависим от него первый фермент - без помощника он “отваливается” от ДНК, встроив лишь один нуклеотид, а если PCNA удерживает на ней полимеразу d, то синтез идет до тех пор, пока фрагмент не достигнет нужной длины. Если в клетке не хватает той или иной ДНК-полимеразы, репарация может переключиться с одного пути на другой, т.е. с малой заплаты на большую (long patch путь BER). Клеточные линии фибробластов мышиных эмбрионов восстанавливают нормальную структуру на месте апуринизации преимущественно посредством малой заплатки (в 80% событий), а если в клетках поврежден ген ДНК-полимеразы b, починка проходит исключительно наложением большой заплаты. Кстати, способ латания дыр клеткой зависит и от того, сколько в ней содержится белка PCNA.
Мелкие неполадки. Если в ДНК изменено одно основание, его распознают, а потом вырезают N-гликозилазы, и в результате в цепи остается дезоксирибозофосфат (как при апуринизации). Далее сахарофосфатный остов надрезается АП-эндонуклеазой (класса II) с 5¢-стороны от этого промежуточного продукта, похожего на АП-сайт. Совсем удалить его клетка может двумя способами (short patch или long patch BER): вырезав только сам остаток дезоксирибозофосфата или вместе с окружающими двумя-десятью нуклеотидами. По размеру образовавшейся дырки синтезируется и заплата. Брешь в один нуклеотид застраивается ДНК-полимеразой b. Иное дело, если появившийся в ДНК АП-сайт еще и подвергся окислению или восстановлению. Такую структурную аномалию вместе с окружающими нуклеотидами вырезает другой фермент - нуклеаза FEN1, - а образовавшуюся брешь застраивают ДНК-полимеразы d или e, которые работают только с помощником - белком PCNA. Иногда короткие пробелы (длиной до 5-6 нуклеотидов) заполняют ДНК-полимеразы b или l. Помощник им не нужен, так как они сами могут временно “заякориться” на свободном 5¢-конце цепи, прилежащем к бреши, и задержаться на какое-то время на ДНК, чтобы осуществить ресинтез вырезанного участка.
Мы несколько лет занимаемся исследованием репарации у костистых рыб в период их эмбрионального развития. В этот период онтогенеза активно синтезируются новые цепи ДНК, и потому риск появления и повторения ошибок многократно увеличивается. Чтобы не произошло подобного, наследственная молекула должна очень быстро залечиваться. Сначала мы предположили, что делящиеся эмбриональные клетки должны иметь несколько равноценных способов устранения одного и того же повреждения. Таким способом одновременно восстанавливалась бы структура ДНК на всех поврежденных участках, и процесс успешно завершался бы даже в том случае, если другие пути репарации подавлены по какой-либо причине. Но вместо того, чтобы экспериментально подтвердить свое предположение, мы обнаружили неизвестный ранее вид репарации ДНК. Работая с эмбрионами и яйцеклетками вьюна (костистой рыбы), мы неожиданно столкнулись с самостоятельной застройкой довольно крупных брешей (до 10-13 нуклеотидов) ДНК-полимеразой d - тем самым ферментом, который, как только что упоминалось, не может обходиться без помощника PCNA. Но в эмбриональном периоде вьюна полимераза d в помощнике не нуждалась. Оказалось, что этот фермент способен связываться одновременно с обоими концами разорванной ДНК [1] и прочно удерживаться там, пока не “залатает дырку” полностью. Этот механизм репарации ДНК в эмбриональных активно делящихся клетках ранее не был известен. Между тем он очень важен, особенно если учесть, что большой заплатой устраняется основное число возникших в ДНК дефектов. Открытый нами способ репарации уникален тем, что действует в экстремальных условиях: совсем без белка-помощника или при его незначительном количестве, а также в том случае, когда в клетке не хватает других ДНК-полимераз, которые обходятся без PCNA.
Не дырка, а затяжка. Ультрафиолетовые лучи вызывают ковалентное сшивание соседних пиримидинов (например, тиминов) в молекуле ДНК. В распознавании и вырезании образовавшихся циклобутановых димеров участвуют семь белков - продуктов генов семейства ХР (XPA-XPG). У человека мутации хотя бы в одном из них могут привести к возникновению наследственного заболевания - пигментной ксеродермы (xeroderma pigmentosum, ХР), которая проявляется в первые годы жизни ребенка. На не защищенных от солнечных лучей участках кожи появляются пигментные пятна и в конце концов может развиться рак кожи.
Зачем нужно так много белков, и как они действуют? Каждый из них играет строго определенную роль. Белок ХРА узнает пиримидиновый димер в ДНК и связывается с другими членами семейства. ХРВ и XPD входят в состав сложного белкового комплекса - фактора транскрипции IIH (TFIIH), который расплетает ДНК в участке, подлежащем вырезанию. Еще один белок - ХРС - удерживает этот комплекс на поврежденном участке ДНК, а два последних (их называют нуклеазами вырезания) - XPF и XPG - работают как ножницы. Первая нуклеаза разрезает 24-ю фосфодиэфирную связь с 5¢-стороны от димера, а вторая - 5-ю связь с 3¢-стороны. В результате их совместного действия образуется разрыв длиной примерно в 30 нуклеотидов [2].

| Стадии восстановления ДНК, в которой образовался циклобутановый димер. Участок с этой структурой, мешающей копированию ДНК, распознают и вырезают эндонуклеазы семейства ХР (ксеродермы), а застраивает образовавшуюся брешь в 29 нуклеотидов полимеразаd(илиe) при наличии фактора репликации (RFC) и белка-помощника (PCNA). |
Заделывают такую большую брешь ДНК-полимеразы d или e, но им нужен помощник PCNA. Более того, для работы первого фермента необходим еще один белок - репликативный фактор С (RFC). В присутствии АТФ он связывается с концом цепи ДНК, который подходит к бреши с 5¢-стороны, затем присоединяется PCNA и образуется нестабильный тройной комплекс. После гидролиза АТФ конформация репликативного фактора меняется так, чтобы удерживать PCNA будто раскрытыми пальцами. Сам же этот помощник за счет временного размыкания своей кольцевой формы насаживается на дуплекс ДНК. К образовавшемуся стабильному комплексу присоединяется ДНК-полимераза d, которая и застраивает большую брешь. Сходным образом работает комплекс с участием ДНК-полимеразы e. Как видно, в устранении объемных повреждений участников много, да и сам процесс довольно сложен.
Если в клетках гены активно транскрибируются (т.е. синтезируется матричная РНК), восстановление по типу вырезания нуклеотида протекает намного быстрее благодаря включению в процесс еще двух белков - CSA и CSB. У человека мутации в генах этих белков вызывают наследственное заболевание - синдром Кокэйна (Cockayne’s syndrom, CS), при котором замедляется рост, повышается фоточувствительность, возникают катаракта, кариес зубов и дерматозы. Если во время транскрипции осуществляющая ее РНК-полимераза II наталкивается на повреждение в ДНК, то связывается с белками CSA и CSB. Тогда быстрая доставка ферментов репарации к месту поломки гарантирована, они залатают прореху, после чего транскрипция может завершиться.
Ткацкие ошибки. Ошибки репликации и рекомбинация (обмен участками) между аллелями могут привести к появлению неспаренных нуклеотидов в цепи ДНК. Для устранения таких неполадок существует особый тип репарации - исправление ошибок спаривания (mismatch repair, MMR). Самый простой путь их коррекции - немедленно удалить неправильно встроенный нуклеотид с помощью все тех же ДНК-полимераз d или e (правда, с дополнительной - экзонуклеазной - активностью). Более сложный вариант осуществляют, совместно действуя, ферменты, которые способны вырезать поврежденный участок (ферменты эксцизионной репарации), и группа дополнительных белков. Они узнают одиночный неспаренный нуклеотид или петли длиной до четырех нуклеотидов. (Мутации генов этих белков у человека вызывают предрасположенность к раковым заболеваниям.) Как только дефект обнаружен, нуклеазы удаляют его вместе с 50-500 нуклеотидами с каждой стороны [3]. Огромную брешь застраивают те же полимеразы, зависимые от PCNA и потому способные синтезировать длинные фрагменты ДНК.
Регуляция. PCNA (о нем уже шла речь как о помощнике в репарации) и белок 53 (р53) - главные регуляторы в клетке, ответственные за ее судьбу. Первый белок, PCNA, участвует в репликации, второй - р53 - в транскрипции. А что делают эти белки, если во время копирования ДНК возникло повреждение, устранить которое должна ДНК-полимераза d? Белок 53 стимулирует синтез белка 21, а тот тормозит копирование ДНК и прохождение клеточного цикла. За время остановки репликации клетка успевает избавиться от дефекта. Как такое может быть, ведь репликация и репарация - это всегда синтез ДНК, в котором задействован один и тот же белок PCNA? Репликация останавливается из-за того, что р21 связывается с PCNA, значит, на репарацию его не будет хватать. Но нет: в области повреждения создается избыток PCNA, и оно успешно ликвидируется.
Некоторые ученые полагают, что при повышенном содержании р21 ресинтез ведет не полимераза d, а полимераза b, которая не чувствительна к действию р21. Мы же, исходя из наших результатов, предполагаем, что смены ферментов не происходит, а просто ДНК-полимераза d переключается с зависимого от PCNA заполнения брешей на независимый от этого белка синтез ДНК [1].
Когда структура ДНК восстановлена, ряд белков-регуляторов и ферментов, участвовавших в репарации, подвергаются гидролизу, который осуществляет 26S протеасома [4]. К таким белкам относится, например, белок XPC. Кроме того, сама протеасома или входящий в ее состав регуляторный комплекс 19S могут играть роль молекулярных шаперонов, способствуя приобретению репаративными белками нужной конформации. В этом случае протеасома стимулирует коррекцию ДНК.
Сквозные разрывы
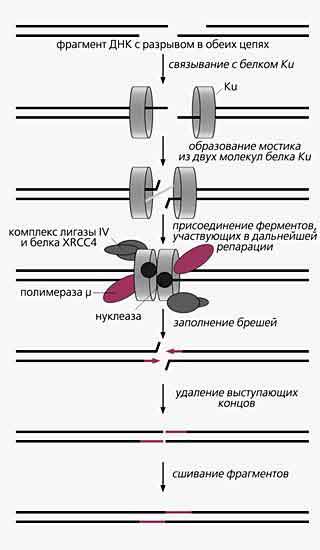
Сквозные разрывы в молекуле ДНК - это результат ионизирующего облучения, окисления или механического повреждения. Такие же поломки возможны в тех случаях, когда во время репликации на пути ДНК-полимераз встречается разрыв в одной цепи. Но двухцепочечные разрывы могут быть и промежуточными продуктами нормальных биологических процессов (например, рекомбинации в развивающихся лимфоидных клетках). Если клетка не может заштопать сквозные разрывы, это приведет к дестабилизации генома, мутациям и возникновению раковых опухолей, а иногда к запуску апоптоза (запрограммированной гибели клетки). У эукариот существует два основных способа устранить двухцепочечные разрывы: гомологичная рекомбинация (рекомбинационная репарация) и соединение негомологичных концов.

| 
|
Последовательность реконструкции ДНК, в которой разорваны обе цепи, способом гомологичной рекомбинации (слева) и соединением негомологичных концов. Первый способ восстановления ДНК характерен для дрожжей (Saccharomyces cerevisiae), второй - для млекопитающих, в том числе для человека.
Дата добавления: 2015-09-10; просмотров: 103 | Поможем написать вашу работу | Нарушение авторских прав |