
Читайте также:
|
Физические свойства, способы получения и испытания этих лекарственных веществ имеют много общего.
 Натрия хлорид получают из минерала галита, а также из подземных рассолов, воды озер и морей выпариванием. Однако при этом остаются примеси. Очистку от них производят последовательно. Вначале раствором хлорида бария осаждают сульфаты и фосфаты:
Натрия хлорид получают из минерала галита, а также из подземных рассолов, воды озер и морей выпариванием. Однако при этом остаются примеси. Очистку от них производят последовательно. Вначале раствором хлорида бария осаждают сульфаты и фосфаты:
 Раствор натрия хлорида отделяют от осадка декантацией, нагревают и обрабатывают избытком карбоната натрия для осаждения примесей солей магния, кальция и бария:
Раствор натрия хлорида отделяют от осадка декантацией, нагревают и обрабатывают избытком карбоната натрия для осаждения примесей солей магния, кальция и бария:
 Раствор вновь декантируют и нейтрализуют хлороводородной кислотой до удаления карбонатов:
Раствор вновь декантируют и нейтрализуют хлороводородной кислотой до удаления карбонатов:
Затем раствор, содержащий только натрия хлорид, упаривают до начала кристаллизации. Кристаллы отфильтровывают и высушивают, нагревая до 200°С.
В последнее время наиболее чистую «выварочную» соль (99,9%) получают упариванием естественных или искусственно приготовленных рассолов в вакуум-выпарительных аппаратах.
Источники получения калия хлорида - минералы сильвинит КС1•NaCl или карналлит КС1•MgC12•6Н2О. Из них выделяют калия хлорид методом флотации, а затем очищают, как и натрия хлорид.
Существуют различные способы промышленного получения бромидов. Один из них основан на использовании бромида железа (II) и (III), который является отходом некоторых химических производств или получается при обработке железных стружек бромом:
3Fe + 4 Br2 = Fe3Br8
 Бромид железа (II) и (III) имеет состав FeBr2 • 2FeBr3. Раствор бромида железа (II) и (III) нагревают до кипения и прибавляют к нему раствор карбоната натрия (до щелочной реакции):
Бромид железа (II) и (III) имеет состав FeBr2 • 2FeBr3. Раствор бромида железа (II) и (III) нагревают до кипения и прибавляют к нему раствор карбоната натрия (до щелочной реакции):
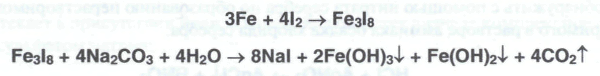 По такой же схеме получают натрия или калия йодиды из йодида железа (II) и (III):
По такой же схеме получают натрия или калия йодиды из йодида железа (II) и (III):
После отделения гидроксидов железа (II) и (III) фильтрат подкисляют соответственно бромоводородной или йодоводородной кислотой и сгущают до кристаллизации. Вначале кристаллизуются дигидраты, которые высушивают при I10-130°С до образования безводной соли.
 Широко применяют способ получения бромидов, основанный на взаимодействии брома с гидроксидом натрия или карбонатом натрия в присутствии восстановителей (формиата натрия):
Широко применяют способ получения бромидов, основанный на взаимодействии брома с гидроксидом натрия или карбонатом натрия в присутствии восстановителей (формиата натрия):
Натрия йодид получают при взаимодействии йода и гидроксида натрия с последующим восстановлением йодата натрия сероводородом или пероксидом водорода:

По физическим свойствам галогениды представляют собой белые или бесцветные кристаллические вещества без запаха, соленого вкуса, легко (йодиды - очень легко) растворимые в воде. Йодиды легко растворимы также в этаноле и глицерине, хлориды и бромиды менее растворимы в этих растворителях.
Для испытания галогенидов на подлинность выполняют качественные реакции на соответствующие катионы и анионы, которые включены в ОФС ГФ РК (вып. 1, с. 159).
 Ион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зелено-желтого кристаллического осадка с цинкуранилацетатом (октаацетат-триуранилатом цинка) в уксуснокислой среде:
Ион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и по образованию зелено-желтого кристаллического осадка с цинкуранилацетатом (октаацетат-триуранилатом цинка) в уксуснокислой среде:
Соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет. Катион калия можно также обнаружить реакцией с винной кислотой (в нейтральной или уксуснокислой среде) по образованию белого кристаллического осадка:

Осадок гидротартрата калия растворяется в разбавленных минеральных кислотах с образованием винной кислоты и в растворах гидроксидов щелочных металлов с получением двухзамещенных тартратов. Соли калия в уксуснокислой среде (рН=4-6) образуют с гексанитрокобальтатом (III)натрия желтый кристаллический осадок:

При действии щелочами происходит превращение в темно-бурый осадок гидроксида кобальта (III):
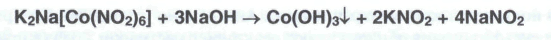 Осадок постепенно приобретает розовую окраску в связи с образованием гидроксида кобальта (II).
Осадок постепенно приобретает розовую окраску в связи с образованием гидроксида кобальта (II).
Галогенид-ионы можно обнаружить осадочной реакцией с раствором нитрата серебра в азотнокислой среде. Образуются трудно растворимые соли галогенидов серебра, которые отличаются по окраске и по растворимости в растворе аммиака: AgCl – белый, AgBr - светло-желтый, AgI – желтый.
Реакции идентификации бромидов и хлоридов проходят по одинаковой схеме. Например, для натрия бромида:

Йодид серебра комплексной соли с аммиаком не образует. Бромид и йодид серебра взаимодействуют с цинком в присутствии 0,1 М раствора серной кислоты:

Бромиды и йодиды обнаруживают также с помощью реакций окисления галогенидов до свободных галогенов, используя различные окислители. Образующиеся галогены извлекают хлороформом и наблюдают окраску хлороформного слоя. Для обнаружения бромид-иона в качестве окислителя используют хлорамин в присутствии хлороводородной кислоты:

Слой хлороформа окрашивается в желто-бурый цвет.
 Йодид-ион окисляют раствором нитрита натрия или другим окислителем в кислой среде:
Йодид-ион окисляют раствором нитрита натрия или другим окислителем в кислой среде:
Выделившийся йод окрашивает слой хлороформа в фиолетовый цвет. Бромиды можно также обнаружить по реакции с раствором сульфата меди (II) и концентрированной серной кислоты. Появляется черный осадок, исчезающий после добавления нескольких капель воды.
Йодиды под действием концентрированной серной кислоты выделяют фиолетовые пары йода. Из раствора иодидов при добавлении ацетата свинца выпадает осадок йодида свинца желтого цвета:

Если образовавшийся осадок растворить при нагревании, а затем охладить, то он снова выделяется, но уже в виде блестящих золотисто-желтых чешуек.
С катионом ртути (II) йодиды дают осадок оранжево-красного цвета, растворяющий-ся в избытке йодидов, с образованием бесцветного раствора:

При испытании на чистоту следует контролировать допустимые пределы содержания примесей катионов кальция, магния, бария, железа, мышьяка, тяжелых металлов, а также бромат-, йодат-, цианид-, тиосульфат-, сульфит- и нитрат-ионов. Примесь броматов в присутствии бромидов обнаруживают добавлением серной кислоты:

При наличии броматов появляется желтое окрашивание. Аналогично устанавливают примесь йодатов. Примесь тиосульфат- и сульфит-ионов обнаруживают реакцией с раствором йода (в присутствии крахмала):

Синее окрашивание должно появляться после добавления не более одной капли 0,1 М раствора йода, что свидетельствует об отсутствии примеси указанных ионов.
Нитрат-ионы обнаруживают по реакции образования аммиака с цинковыми или железными опилками в щелочной среде:

Выделяющийся аммиак окрашивает (при наличии примеси нитратов) влажную красную лакмусовую бумагу в синий цвет.
 Количественное определение галогенидов выполняют аргентометрическим методом. Лекарственные препараты хлоридов и бромидов титруют в нейтральной среде, в качестве индикатора используют хромат калия (метод Мора). Реакции проходят по схеме:
Количественное определение галогенидов выполняют аргентометрическим методом. Лекарственные препараты хлоридов и бромидов титруют в нейтральной среде, в качестве индикатора используют хромат калия (метод Мора). Реакции проходят по схеме:
 Избыток титранта (первая капля) взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливают конечную точку титрования:
Избыток титранта (первая капля) взаимодействует с индикатором с образованием осадка оранжево-красного цвета, по которому устанавливают конечную точку титрования:
Йодиды определяют методом Фаянса в уксуснокислой среде, используя в качестве титранта 0,1 М раствор нитрата серебра и адсорбционный индикатор - эозинат натрия. После осаждения йодид-ионов образующиеся коллоидные частицы иодида серебра от добавления избытка ионов серебра становятся положительно заряженными:

Одновременно с приобретением положительного заряда коллоид [AgI • Ag+] притягивает отрицательно заряженный ион индикатора эозината натрия. В конечной точке титрования окраска поверхности коллоидных частиц (т.е. осадка) изменяется из желтой в розовую.
По МФ калия хлорид количественно определяют обратным аргентометрическим методом в среде дибутилфталата. Избыток 0,1 М раствора нитрата серебра оттитровывают 0,1 М раствором тиоцианата аммония, в присутствии индикатора аммоний-железо (III) сульфата (железоаммониевые квасцы).
Калия йодид по МФ количественно определяют прямым аргентометрическим методом в присутствии смеси 50 мл раствора крахмала и 1 капли раствора йода в этаноле. Титруют до желтого окрашивания.
С целью замены дорогостоящего нитрата серебра для количественного определения йодидов используют способ, основанный на окислении их до элементного йода. В качестве окислителя применяют 10%-ный раствор сульфата (II) меди в кислой среде. Выделившееся эквивалентное количество йода оттитровывают тиосульфатом натрия (индикатор крахмал). Описан способ, основанный на окислении йодидов нитритом натрия (калия), позволяющий выполнять определение в присутствии хлоридов, бромидов и различных восстановителей:
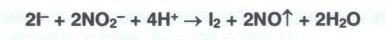
Имеется также прямой меркуриметрический метод определения йодидов с использованием в качестве титранта 0,01M раствора ‒ перхлората ртути (II) Hg(C1О4)2, устойчивого при хранении. Индикатор дифенилкарбазон. Титруют в спирто-водной среде, исключающей выпадение осадка дийодида ртути.
Для количественного определения галогенидов можно использовать метод ионообменной хроматографии, с последующим алкалиметрическим завершением.
Натрия и калия хлориды хранят в сухом месте в плотно укупоренных банках. Бромиды и йодиды, кроме того, предохраняют от действия света (в склянках оранжевого цвета). Калиевые соли бромидов и йодидов отличаются меньшей гигроскопичностью. Они могут содержать лишь до 1 % влаги, в то время как натриевые соли ‒ до 4-5%.
Применение в медицинской практике лекарственных веществ хлоридов, бромидов, йодидов натрия и калия различно.
Натрия хлорид ‒ основная составная часть солевых и коллоидно-солевых растворов, применяемых в качестве плазмозаменяющих жидкостей. Применяют также (наружно и внутривенно) гипертонические растворы натрия хлорида (3, 5, 10%-ные) и изотонический (0,9%-ный) раствор натрия хлорида.
Калия хлорид является антиаритмическим средством и источником ионов калия (при гипокалиемии). Он также входит в состав плазмозамещающих жидкостей.
Натрия и калия бромиды применяют в качестве седативных (успокаивающих) средств внутрь и внутривенно. Выпускают их в виде ампулированных 5,10 и 20%-ных растворов по 10 мл.
Йодиды применяют при недостатке йода в организме (эндемическом зобе) и некоторых воспалительных заболеваниях.
Дата добавления: 2015-09-11; просмотров: 354 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Бескислородные соединения галогенов | | | Натрия фторид |