
Читайте также:
|
В химической реакции не всегда происходит непосредственное превращение исходных молекул в молекулы продуктов реакции. В большинстве случаев реакция протекает в несколько стадий. Совокупность стадий, из которых состоит химическая реакция, называют механизмом химической реакции. При изучении химических превращений в первую очередь следует устанавливать механизм химической реакции, поскольку именно он обусловливает конкретный вид кинетического уравнения.
Стехиометрическое уравнение химической реакции, как известно, показывает, в каких количественных соотношениях вещества вступают во взаимодействие. Однако фактически реакция редко протекает по схеме, описываемой стехиометрическим уравнением. Например, реакция взаимодействия водорода и брома записывается стехиометрическим уравнением:
Н2 +Br2 = 2HBr (8.19)
В действительности же реакция протекает по более сложной схеме:
Br2 = 2 Br•
Br• + Н2 = HBr + Н•
Н• + Br2 = HBr + Br• (8.20)
Н• + HBr = Н2 + Br•
2 Br• = Br2
Таким образом, стехиометрическое уравнение (8.19) отражает суммарный эффект ряда реакций (8.20). Следовательно, о механизме реакции нельзя судить только по ее стехиометрическому уравнению. Практически механизм реакции устанавливается опытным путем. С этой целью формулируют наиболее вероятные гипотезы механизма изучаемой реакции и выбирают ту из них, которая лучше всего соответствует опытным данным, полученным для указанной реакции.
Наиболее простым является механизм реакции, которая протекает в одну стадию. Химические реакции, протекающие в одну стадию, т. е. осуществляющиеся путем прямого перехода реагирующих частиц в продукты реакции, называются элементарными реакциями. Каждая элементарная реакция складывается из большого числа одинаковых повторяющихся превращений исходных частиц – элементарных актов химического превращения. Реакции, в элементарном акте которых участвуют одна, две или три частицы, называются соответственно мономолекулярными, бимолекулярными и тримолекулярными. Реакции более высокой молекулярности практически не встречаются.
Для элементарных реакций стехиометрические уравнения всегда выражают истинный механизм химического превращения и, следовательно, определяют кинетические уравнения в виде степенной зависимости. Для элементарных реакций порядок реакции и ее молекулярность совпадают.
При отсутствии прямой связи между стехиометрическими и кинетическими уравнениями реакции являются неэлементарными, их стехиометрические уравнения не отвечают истинному механизму химического превращения. Примером неэлементарной реакции служит взаимодействие водорода и брома. По виду стехиометрического уравнения (8.19) такую реакцию можно было бы считать элементарной, но ее стехиометрическое уравнение не описывает истинный механизм реакции, о чем свидетельствует экспериментально установленное для этого превращения следующее кинетическое уравнение:
 (8.21)
(8.21)
где: k1 и k2 – константы скоростей элементарных реакций, охватывающие все пять элементарных стадий. Очевидно, уравнение (8.21), которое достаточно точно описывает опытные данные, нельзя получить непосредственным применением закона действующих масс к стехиометрическому уравнению реакции (8.19). В рассмотренной реакции, как и во всех других одностадийных неэлементарных реакциях стехиометрическое уравнение отражает суммарный эффект ряда элементарных реакций.
По количеству стехиометрических уравнений, необходимых для описания химического превращения, различают простые и сложные реакции. Если одного стехиометрического уравнения достаточно, чтобы описать протекание данной реакции, то ее относят к простым реакциям. Если же для описания наблюдаемого течения реакции необходимо несколько стехиометрических и кинетических уравнений, то ее относят к сложным реакциям. Сложные реакции разделяют на последовательные, параллельные и смешанные.
Приведем примеры простых элементарных реакций и соответствующие им кинетические уравнения:

Большинство химических реакций являются сложными, т. е. такими, которые протекают в несколько стадий и при этом могут иметь прямое и обратное направления. Составление кинетических уравнений сложных процессов основано на независимом протекании элементарных реакций. Согласно этому принципу, величина константы скорости химической реакции не зависит от того, протекают ли в данной системе одновременно и другие элементарные реакции.
В сложном химическом процессе одно и то же вещество может принимать участие в качестве исходного или конечного компонента на различных стадиях. Поэтому при составлении кинетических уравнений сложной реакции ее представляют состоящей из нескольких независимо протекающих элементарных реакций и для описания каждой из них используют кинетические закономерности элементарного акта химического превращения.
Полное изменение концентрации i -го компонента сложной реакции будет алгебраической суммой скоростей его образования или расходования на всех элементарных стадиях, где участвует в реакции этот компонент. Сложные реакции математически описываются системами дифференциальных кинетических уравнений, количество которых определяется числом реагирующих веществ. Приведем примеры сложных химических реакций и соответствующие им кинетические уравнения:
последовательная реакция 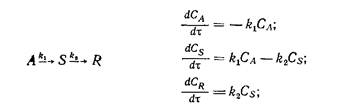
параллельная реакция 
смешанная реакция 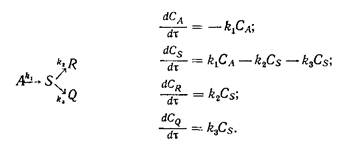
Здесь k1, k2, k3 – константы скорости реакции соответствующих стадий.
Аналитическое решение кинетических уравнений даже простых реакций требует громоздких вычислений, а в ряде случаев вообще невозможно. В литературе приводятся точные решения кинетических уравнений некоторых сложных реакций, стехиометрические коэффициенты которых равны единице (см. таблицу 8.1). Для сложных реакций, описываемых системами кинетических дифференциальных уравнений (как правило, нелинейных), найти решение аналитическим способом крайне затруднительно.
При изучении реакций, кинетические уравнения которых не поддаются аналитическому решению, исследователи вынуждены были применять методы приближенного численного интегрирования. Однако эти методы громоздки и требуют большого объема вычислительной работы. По указанным причинам нередко приходилось вообще отказываться от аналитического решения задачи и пользоваться лишь эмпирическими данными.
В настоящее время при изучении кинетики химических реакций (особенно сложных) используют компьютеры и современное программное обеспечение, которые позволяют получать решения кинетических уравнений путем моделирования процесса химического превращения. Созданы современные методики планирования эксперимента, позволяющие сократить количество трудоемких и длительных экспериментов, что значительно облегчает и ускоряет работу исследователя. Но главное преимущество состоит в том, что на ЭВМ можно решать и те задачи, для которых точное аналитическое решение невозможно, а приближенное слишком трудоемко, и связано с большими затратами времени.
Таблица 8.1.
Дата добавления: 2014-12-15; просмотров: 159 | Поможем написать вашу работу | Нарушение авторских прав |