
Читайте также:
|
10.Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Порядок связи.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1 s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1 s 1 и 1 s 2 – МО± = C 11 s 1 ± C 21 s 2.
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s -орбитали участвуют в линейной комбинации (C 1 = C 2 = C). Поскольку должно вы  полняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2 C 2 = 1, откуда Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
полняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2 C 2 = 1, откуда Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
|
Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают)
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленный на два.
11.Электродный потенциал. Водородный электрод сравнения. Уравнение Нернста.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и растворомэлектролита).
Водородный электроды сравнения представляет собой кусочек платиновой фольги или сетки, покрытый слоем электролитической Pt и погруженный частично в раствор, через который пропускают Н2. При адсорбции на электроде образуются адсорбированные атомы Надс. Электродные реакции на водородном электроды сравнения описываются уравнениями: Н2  2Надс
2Надс  2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода р Н2равном 1 атм (1,01 х 105 Па), термодинамической активности ионов водорода в растворе а Н+, равной 1, называют стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Дня водородного электроды сравнения уравнение Нернста записывается в виде:
2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода р Н2равном 1 атм (1,01 х 105 Па), термодинамической активности ионов водорода в растворе а Н+, равной 1, называют стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Дня водородного электроды сравнения уравнение Нернста записывается в виде:
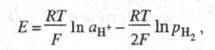
где Т - абс. температура; F - постоянная Фарадея. R - газовая постоянная. При р Н2 = 1 атм электродный потенциал
12.Гидролиз солей. Уравнения реакций гидролиза.
Дата добавления: 2015-01-30; просмотров: 237 | Поможем написать вашу работу | Нарушение авторских прав |