
Читайте также:
|
Пример 1. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза. Пишем уравнение диссоциации соли: CuSO4 = Cu 2+ +.
«Правило цепочки»: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду: Cu2+ + H–OH CuOH+ + H+.
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4.
Продукт реакции относится к группе основных солей - «сульфат гидроксомеди(II)
13.Второй закон термодинамики для изолированных и закрытых систем.=9
14.Причина образования химической связи. Метод валентных связей.
Химическая связь – это совокупность сил, действующих между атомами или группой атомов.
различают три основных типа химической связи: ковалентную, ионную, металлическую.
Валентных связей метод (метод валентных схем), метод приближенного решения электронного уравнения Шрёдингера для многоэлектронных молекулярных систем
15.Электрохимические способы защиты металлов от коррозии. Металлические покрытия. Электрохимическая защита.
анодные покрытия. Металл покрытия является более электро-отрицательным, чем защищаемый металл. При нарушении целостности покрытия разрушаться будет покры-тие. Примером анодного покрытия может служить хром, нанесенный на железо.
Катодные покрытия. У катод-ного покрытия стандартный эле-ктродный потенциал более поло-жителен, чем у защищаемого металла. При нарушении сплош-ности катодного покрытия оно перестает защищать металл от коррозии.
Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяриза-тора, либо в изоляции металла от деполяризатора.
Протекторная защита.
Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равно-сильно созданию гальванического элемента, в котором протектор явля-ется анодом и будет разрушаться.
Катодная защита отличается от протекторной тем, что защища-емая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внеш-него источника тока. В ту же сре-ду помещают кусок металлолома, который соединяют с анодом внешнего источника тока

16.Водородная связь, межмолекулярные взаимодействия.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ, взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. Связей.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода
отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи.
17.Энтропия и термодинамическая вероятность. Формула Больцмана. Абсолютные энтропии химических соединений.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Поскольку число частиц в системе велико (число Авогадро N A = 6,02∙10 23), то энтропия пропорциональна натуральному логарифму термодинамической вероятности состояния системы W:
|
18.Электродный потенциал. Водородный электрод сравнения. Уравнение Нернста.=11
19.Метод валентных связей. sp3 -гибридизация. Изоэлектронные молекулы: CH4, NH3, H2O.
Валентных связей метод (метод валентных схем), метод приближенного решения электронного уравнения Шрёдингера для многоэлектронных молекулярных систем.
sp 3- Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s - и трех p -электронов.

Изоэлектронные молекулы - молекулы, имеющие равное число электронов
20.Скорость химической реакции. Факторы, влияющие на скорость реакции. Закон действующих масс для гомогенных и гетерогенных реакций.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t, присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Суть закона действующих масс (закона действия масс) состоит в том, что скорость химической реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам этих веществ в уравнении реакции. Для реакции
n A A + n B B +... → n C C + n D D +...
закон действующих масс запишется следующим образом:
v =  , где
, где
c A, c B,... - концентрации реагирующих веществ A, B,...;
n A, n B,... - порядки реакции по соответствующим реагентам (как правило, совпадают со стехиометрическими коэффициентами этих реагентов в уравнении реакции);
k - коэффициент пропорциональности, константа скорости реакции, зависящая от природы реагирующих веществ и от температуры;
v - скорость реакции.
Данное уравнение носит название кинетического уравнения реакции.
В состоянии термодинамического равновесия концентрации всех реагирующих веществ, согласно закону действующих масс, связаны соотношением (константа равновесия):
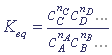
Концентрация твердого вещества в процессе химического превращения не меняется (процесс идет на поверхности), поэтому скорость в реакциях с участием твердого тела определяется только концентрацией газов или растворенных веществ.
В сложных (многостадийных) реакциях скорость всего процесса зависит от скорости наиболее медленной реакции.
21.Закон Гесса. Тепловые эффекты химических реакций. Примеры расчетов.
Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
ΔH = Hкон. – Hисх. = Eкон. – Eисх.
22.Насыщаемость химической связи. Сравнение валентностей у серы и кислорода; хлора и фтора.
Насыщаемость связи обеспечивает постоянный состав молекул и определяет понятие валентность.
Если в атоме имеется п неспаренных электронов, то этот атом может образовать п химических связей с другими атомами, имеющими по одному неспаренному электрону. Поэтому валентность элемента равна числу неспаренных электронов в атоме или числу образующихся ковалентных связей.
23.Электроды второго рода (хлорид-серебряный электрод). Измерение электродных потенциалов металлов.
лектроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl– представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Измерение потенциалов
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
24.Электролитическая диссоциация в водных растворах. Слабые электролиты. Константа и степень диссоциации слабого электролита.
Электролитической диссоциацией называют процесс распада молекул на ионы под действием растворителя.
Вещества, молекулы которых подвергаются диссоциации, называются электролитами.
Степень диссоциации α– выражается отношением числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n+N):
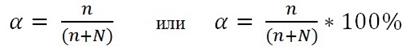
Электролиты называют сильными, если α > 0,3 (> 30%). К ним относятся многие кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4,HMnO4, H2Cr2O7, H2Cr2O4 и др.), гидроксиды щелочных и щелочноземельных металлов, почти все растворимые соли.
Электролиты называют слабыми, если α < 0,03 (α < 3%). К ним относятся многие кислоты (HNO2, HF, H2CO3, H2SiO3, H3BO3 и др.), вода, водный раствор аммиака NH3* H2O, гидроксиды металлов и др.
Для более точной оценки силы слабых электролитов служит константа электролитической диссоциации (Кд). Константа диссоциации Кдхарактеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.
В общем виде для процесса электролитической диссоциации, выражаемого уравнением:
KmAn ↔ mKn+ + nAm-
константа диссоциации равна:

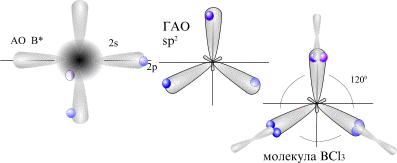
25.Направленность химической связи. Гибридизация атомных орбиталей. Строение молекул BeCl2.
Направленность связи выражается в том, что она имеет вполне определенную форму. Связь, образованную электронным облаком, имеющим максимальную плотность на линии, соединяющей центры атомов, называют сигма-связью. Связь, образованную электронами, орби-тали которых дают наибольшее перекрывание по обе стороны от линии, соединяющей центры атомов, называют пи-связью.
Гибридизация АО - это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.

26.Уравнение Нернста. Концентрационный гальванический элемент.=11
Гальвани́ческий элеме́нт — химический источник электрического тока.
В концентрационных цепях электроды и электролит - одинаковой природы. Напряжение в гальваническом элементе возникает за счет разности концентраций электролитов в обеих полуэлементах.
27.Равновесие малорастворимый электролит – насыщенный раствор. Произведение растворимости. Условия выпадения и растворения осадка.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении.
Условие выпадения осадка только одно: произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре.
28.Направленность химической связи. Гибридизация атомных орбиталей. Строение молекулы BCl3.=25
29.Электролиз. Анодное окисление и катодное восстановление. Последовательность разряда ионов.
Электролиз –это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного элек-трического тока через растворы или расплавы электролитов.
КАТОД в гальваническом элементе
является ПОЛОЖИТЕЛЬНЫМ, а АНОД –
ОТРИЦАТЕЛЬНЫМ электродом.
В электролизе наоборот:
АНОД является ПОЛОЖИТЕЛЬНЫМ,
а КАТОД – ОТРИЦАТЕЛЬНЫМ электродом.
Однако независимо от знака заряда
электрода на КАТОДЕ всегда протекает
процесс ВОССТАНОВЛЕНИЯ, а на
АНОДЕ- процесс ОКИСЛЕНИЯ.
30.Энергия активации. Теория активированного комплекса. Уравнение Аррениуса.
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях намоль), чтобы произошла реакция.
имическая реакция между началом и завершением претерпевает некое «переходное состояние», как его назвали Эванс и Поляни, при котором образуется неустойчивый «активированный комплекс» (термин Эйринга). Энергия активации как раз и требуется для достижения этого состояния, при котором вероятность успешного завершения реакции весьма велика. Поэтому энергия активации и может быть меньшей, чем энергия разрыва исходных химических связей.
Суть теории переходного состояния (активированного комплекса):
1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции  от температуры
от температуры 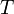 .
.
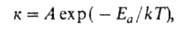
31.Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Порядок связи. =10
32.Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Окислительно-восстановительный потенциал. Направление протекания окислительно-восстановительных реакций.=2
| осстановители | Окислители |
| Металлы | Галогены |
| Водород | Перманганат калия(KMnO4) |
| Уголь | Манганат калия (K2MnO4) |
| Окись углерода (II) (CO) | Оксид марганца (IV) (MnO2) |
| Сероводород (H2S) | Дихромат калия (K2Cr2O7) |
| Оксид серы (IV) (SO2) | Хромат калия (K2CrO4) |
| Сернистая кислота H2SO3 и ее соли | Азотная кислота (HNO3) |
| Галогеноводородные кислоты и их соли | Серная кислота (H2SO4) конц. |
| Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3 | Оксид меди(II) (CuO) |
| Азотистая кислота HNO2 | Оксид свинца(IV) (PbO2) |
| Аммиак NH3 | Оксид серебра (Ag2O) |
| Гидразин NH2NH2 | Пероксид водорода (H2O2) |
| Оксид азота(II) (NO) | Хлорид железа(III) (FeCl3) |
| Катод при электролизе | Бертоллетова соль (KClO3) |
| Металлы | Анод при электролизе |
33.Энтропия и термодинамическая вероятность. Формула Больцмана. Абсолютные энтропии химических соединений.=17
34.s -элементы, p - элементы, d - элементы, f - элементы.
s-блок в периодической таблице элементов — электронная оболочка, включающая в себя первые два слоя s-электронов.
Данный блок включает в себя щелочные металлы, щелочноземельные металлы, водород и гелий.
p-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь.
В p-блок входят последние шесть групп, исключая гелий (который находится в s-блоке). Данный блок содержит все неметаллы (исключая водород и гелий) и полуметаллы, а также некоторые металлы.
d-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают d-орбиталь.
f-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают f-орбиталь.
В данный блок входят актиноиды и лантаноиды.
35.Свободная энергия Гиббса. Условия самопроизвольного протекания процессов в изобарно-изотермических условиях.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
36.Электролиз с растворимым и нерастворимым анодом.
нету
37.Поляризуемость химической связи. Дипольный момент. Ионная связь как предельный случай образования химической связи.
Если вкратце - под поляризуемостью химической связи подразумевают ее способность к перераспределению электронной плотности под действием электрического поля или других атомов. Чем больше размер атома и число его валентных электронов, тем выше поляризуемость химической связи, образуемой этим атомом.
Дипольный момент электрический, физическая величина, характеризующая электрические свойства системы заряженных частиц. Дипольный момент системы из N заряженных частиц равен

где ei — заряд частицы номера i, а ri — её радиус-вектор
38.Внутренняя энергия и энтальпия систем. Первый закон термодинамики. Тепловой эффект химической реакции. =3
1ый закон термодинамики –под действием силы на тело совершается работа равная произведению силы на смещение,вызванное этой силой.
тепловой эффект - количество теплоты, выделившееся или поглощенное химической системой при протекании в ней химической реакции.
39.Гидролиз солей. Уравнения реакций гидролиза. =12
40.Корпускулярно-волновой дуализм электрона. Волновое уравнение Шредингера. Характеристика состояния электрона в атоме системой квантовых чисел.=1
41.Окислительно-восстановительные реакции. Направление их протекания. Red-Оx потенциалы.=2
42.Первый закон термодинамики. Энтальпия, стандартная энтальпия образования. Связь энтальпии с прочностью вещества.=38
энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
энтальпия образования — количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ.
43.Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Порядок связи.=10
44.Энергия активации. Теория активированного комплекса. Уравнение Аррениуса.=30
45.Равновесие малорастворимый электролит – насыщенный раствор. Произведение растворимости. Условия выпадения и растворения осадка.=27
46.Принцип Паули, правило Гунда, правила Клечковского, принцип наименьшей энергии.=4
47.Электролиз с растворимым и нерастворимым анодом.=36
48.Химическое равновесие. Обратимые и необратимые реакции. Константа химического равновесия, ее связь с термодинамическими характеристиками системы.
Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Константа химического равновесия — характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях
49.Энергии ионизации, сродство к электрону, электроотрицательность; закономерности изменения этих величин по группам и периодам.=7
50.Гидролиз солей. Уравнения реакций гидролиза. =12
51.Теория гальванического элемента. ЭДС. Связь ЭДС с энергией Гиббса.
52.Насыщаемость химической связи. Сравнение валентностей у серы и кислорода, хлора и фтора. =22
53.Зависимость скорости реакций от концентрации реагирующих веществ. Основной закон химической кинетики. Простые и сложные реакции
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, 1864-1867 ): Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Простые-в одну стадию,сложные в неск.
54.Электролитическая диссоциация в водных растворах. Слабые электролиты. Константа и степень диссоциации слабого электролита. =24
55.Направленность химической связи. Гибридизация атомных орбиталей. d- и p-связи. =25
56.Водные растворы электролитов. Особенности воды как растворителя. Водородный показатель среды (рН).
Водные растворы электролитов, образующиеся при растворении ионных соединений в растворителе, проявляют особые свойства, которые играют важную роль в различных областях химии.
Вода — хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды — диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, — отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
57.Стандартный водородный электрод. Зависимость потенциала водородного электрода от рН раствора.
| Стандартный водородный электрод |
| Это специально сконструированной электрод, в котором происходит окислительновосстановительная реакция: 2Н+ + 2е ↔ Н2. При этом концентрация ионов водорода является одномолярной, давление водорода равняется 1 атм. и поддерживается температура 25°С. |
5. ММО. Двухатомные молекулы и молекулярные ионы элементов второго периода.
Дата добавления: 2015-01-30; просмотров: 279 | Поможем написать вашу работу | Нарушение авторских прав |