
где [А], [В2] – молярные концентрации реагирующих веществ, а коэффициент k называется константой скорости химической реакции, который зависит от природы реагирующих веществ.
Данную формулу можно применять, если в качестве реагирующих веществ выступают идеальные газы или сильно разбавленные растворы. Если в реакции участвуют вещества в твердой фазе, то при записи закона действия масс их не нужно учитывать.
Формулу также нельзя применить к реакциям сумма показателей степеней концентраций которых больше трех. Так как вероятность одновременного столкновения трех и более молекул невелика, такие реакции идут в несколько стадий.
Пример 2. Как изменится скорость реакции: NO(г.) + O2(г.) ↔ NO2(г.), если уменьшить объем реакционного сосуда в 3 раза?
Решение. Расставим коэффициенты в уравнении: 2NO(г.) + O2(г.) ↔ 2NO2(г.)
До изменения объема скорость реакции выражалась уравнением: υ1 = k[NO]2[O2].
Вследствие уменьшения объема концентрация каждого из реагирующих веществ возросла в 3 раза. Следовательно, теперь: υ2 = k(3[NO])2(3[O2]) = 27 k [ NO ]2[O2].
Сравнивая выражения для υ1 и υ2 видим, что скорость реакции возросла в 27 раз.
Ответ: скорость реакции возросла в 27 раз.
5) Влияние катализаторов. Вводимые в реакционную систему в небольших количествах, катализаторы значительно изменяют скорость реакции и выделяются в конце реакции в химически неизменном состоянии.
Каждая реакция характеризуется энергетическим барьером (который помогает снизить катализатор). Для его преодоления необходима энергия активации ЕА – некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости реакции от энергии активации выражается уравнением Аррениуса:
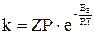 ,
,
где Z-число столкновений молекул в секунду в единице объёма, Т-температура, R-универсальная газовая постоянная, Р - вероятность того, что столкновение двух молекул приведёт к образованию нового вещества.
Пример 3. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж\моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастёт скорость реакции в присутствии катализатора, если реакция протекает при 298 К.
Решение. Обозначим энергию активации реакции без катализатора через ΕА1, а с катализатором через ΕА2; соответствующие константы скорости реакции обозначим через k и k’. Используя уравнение Аррениуса находим:
 отсюда:
отсюда: 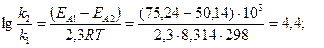
Ответ: скорость реакции возросла в 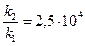 (25 тысяч раз).
(25 тысяч раз).
6) Влияние инициаторов. Имеется большая группа химических реакций – окисление молекулярным кислородом, процессы полимеризации и др., которые начинаются в присутствии инициаторов. Инициаторами называют вещества, которые легко распадаются на активные частицы (радикалы, свободные атомы, возбужденные молекулы и др.). В качестве инициаторов используют пары натрия, некоторые перекисные и азосоединения. Реакции, протекающие с участием активных частиц, называются цепными.
7) Влияние электромагнитного излучения. Реакции, протекающие под влиянием электромагнитного излучения ультрафиолетового или видимого участка спектра, называются фотохимическими. При поглощении кванта света молекулы возбуждаются и становятся реакционноспособными. К фотохимическим реакциям относятся фотосинтез, выцветание красок и др.
Большинство химических реакций обратимы, то есть протекают одновременно во взаимно противоположных направлениях. Состояние химического равновесия сохраняется до тех пор, пока не изменятся внешние условия. В этом случае могут неодинаково измениться скорости прямой и обратной реакции, и произойдет сдвиг (смещение) равновесия.
Закономерности, которые наблюдаются при смещении химических равновесий, охватывает принцип Ле Шателье:
если на систему, находящуюся в состоянии равновесия, оказать какое-либо внешнее воздействиее, то в системе усилится реакция (прямая или обратная), течение которой ослабляет влияние этого воздействия.
Следствие 1. При увеличении температуры ускоряются и прямая, и обратная реакции, а равновесие смещается в сторону эндотермической реакции, а при уменьшении замедляются и прямая, и обратная реакции, а равновесие смещается в сторону экзотермической реакции.
Следствие 2. Принимая во внимание, что молярные объемы различных газов при одинаковых условиях также одинаковы при увеличении давления в газовых смесях равновесие смещается в сторону образования меньшего числа молей газов, а при увеличении давления – в сторону образования большего числа молей газов.
В процессах, протекающих в жидеих фазах значительных изменений объемов происходить не может и изменение давления не вызывает значительных смещений равновесий.
Следствие 3. При увеличении концентрации какого либо компонента системы равновесие смещается в сторону расхода этого компонента.
Следствие 4. Участие катализатора приводит к равномерному ускорению как прямой, так и обратной реакции и в связи с этим не оказывает влияния на смещение равновесия.
Химическая реакция mA+nB↔pC+qD (где n, m, p и q указывают число молекул А, В, С и D) протекает при постоянных давлении и температуре. В ходе реакции число молей исходных веществ А и В уменьшается, а число молей продуктов реакции C и D увеличивается.
. Химическое равновесие это состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. применив закон действия масс для гомогенной системы, зависимость прямой и обратной реакции от концентрации реагирующих веществ определяется выражениями:
vпр.= k пр.[А]m[В]n, vобр.= k обр.[С]p[D]q и при vпр.= vобр. получим что


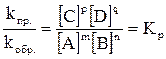 .
. 
Константа равновесия системы представляет собой отношение констант скорости прямой и обратной реакции или отношение произведения концентрации продуктов реакции к произведению концентраций исходных веществ.
Величина Кр связана с изменением энергии Гиббса следующим уравнением:
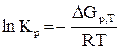
Пример 4. При некоторой температуре константа диссоциации йодовородорода на простые вещества равна 6,25·10-2. Какой процент HI диссоциирует при этой температуре?
Решение. Уравнение диссоциации HI:
2HI(г.) ↔ H2(г.) + I2(г.)
Обозначим начальную концентрацию HI через С (моль/л). Если к моменту наступления равновесия из каждых С молей йодоводорода диссоциировало х молей, то при этом, согласно уравнения реакции, образовалось 0,5 молей водорода и йода соответственно. Таким образом, равновесные концентрации составляют: [HI]=(C – x) моль/л; [H2] = [I2] = 0,5х моль/л
Подставим эти значения в выражение константы равновесия реакции:
Кравн = 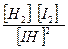
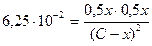 , х = 0,333
, х = 0,333
если С – 100%, то х=33,3%
Ответ: 33,3%
Пример 5. В каком направлении сместится равновесие в системах: а) СО(г.) + Сl2(г.) ↔ СОСl2(г.); б) 2HI(г.) ↔ H2(г.) + I2(г.), если при неизменной температуре увеличить давление газовой смеси.
Решение. а) Протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле-Шателье, повышение давления вызовет смещение равновесия в сторону прямой реакции.
б) Протекание реакции не сопровождается изменением числа молей газов, и изменение давления не вызовет смещение равновесия в системе.
Пример 6. Используя справочные данные, найти значение температуры, при которой константа равновесия реакции образования водяного газа: С(графит) + Н2О(г.) ↔ СО(г.) + Н2(г.) равна единице.
Решение. Из уравнения 1пКравн= - ∆Gp,T / (R ∙ T) следует, что при Кравн=1 стандартная энергия Гиббса химической реакции равна нулю. Тогда из соотношения ∆G0T = ∆H0T - T∆S0T вытекает, что Т = ∆H0T / ∆S0T. Воспользовавшись табличными данными находим, что ∆Н = 131,3 кДж, а ∆S = 0,1336 кДж/К, отсюда Т = 131,3 / 0,1336 = 983 К.
Ответ: 983 К.
Контрольные вопросы
47. Во сколько раз изменится скорость реакции: 2А(г.) + В(г.) → А2В(г.), если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? В каком направлении сместится равновесие данной реакции с повышением давления?
48. Во сколько раз следует увеличить концентрацию вещества В в системе: 2А(г.) + В2(г.)→ 2АВ(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
49. В каком направлении произойдет смещение равновесия при повышении температуры систем: СОСl2 ↔ CO + Cl2, ∆H = -113 кДж; 2SO3 = 2SO2 + O2, ∆H = 192 кДж?
50. В 2 сосуда одной и той же вместимости помещены: в первый – 1 моль газа А и 2 моля газа В, во второй – 2 моля газа А и 1 моль газа В при одинаковой температуре. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением U1= k 1[А][В]; б) уравнением U2 = k2[А]2[В]?
51. Как изменится скорость реакции: NO(г.) + О2(г.) → NO2(г.), если а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию NO в 3 раза?
52. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции увеличивается в 15,6 раза?
53. Вычислите, во сколько раз возрастает скорость химической реакции при увеличении температуры на 40 0С, если температурный коэффициент этой реакции равен 3.
54. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость реакции при повышении температуры на 25 градусов.
55. Некоторая реакция при температуре 25 0С завершается за два часа. Через какое время закончится эта реакция при температуре 75 0С, если ее температурный коэффициент равен двум.
56. В системе: А(г.) + 2В(г.) → С(г.) равновесные концентрации равны: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Найдите константу равновесия реакции.
57. Рассчитайте константу равновесия реакции: SO3(г.) ↔ SO2(г.) + О2(г.), пользуясь справочными данными ∆G.
58. Реакция восстановления диоксида углерода углем выражается уравнением: СО2(г)+ С(тв.) = 2СО(г), DH= -172,6 кДж. В какую сторону сместится равновесие в системе при повышении температуры; нарушится ли равновесие при увеличении давления?
59. Во сколько раз следует увеличить давление газовой смеси, чтобы скорость образования АВ по реакции 2А + В Û 2АВ возросла в 1000 раз?
60. Константа равновесия реакции: FеО(к.) + СО(г.) ↔ Fе(к.) + СО2(г.) при некоторой температуре равна 0,5. Найдите равновесные концентрации
61. Вычислите равновесные концентрации водорода и йода если известно, что их начальные концентрации составляли 0,02 моль/л, а равновесная концентрация НI – 0,03 моль/л. Вычислите константу равновесия.
62. В какую сторону сместится равновесие в системе N2 + 3Н2 Û 2NН3 ; DH= -92,4 кДж при понижении давления? Ответ дайте на основании принципа Ле Шателье и подтвердите расчетом скоростей прямой и обратной реакцией при условии, что давление понизилось в 3 раза.
63. Химическое равновесие реакции разложения оксида азота (IV) до оксида азота (II) и кислорода установилось при следующих концентрациях: [NО2] = 0,06 моль/л, [NО] = 0,24 моль/л и [О2] = 0,12 моль/л. Рассчитайте константу равновесия данной реакции и исходную концентрация оксида азота (IV).
64. Как изменится скорость химической реакции: С(т.) + H2(г.) ↔ CH4(г), если концентрацию водорода уменьшить в 3 раза?
65. В каком направлении сместится равновесие: Н2(г.) + О2(г.) ↔ Н2О(г.), ∆Н0 = -483,6 кДж а) при повышении давления; б) при повышении температуры. Ответ обоснуйте.
66. В каком направлении сместится равновесие: СаСО3(к.) ↔ СаО(к.)+СО2(г.) ∆Н0= 179 кДж а) при повышении давления; б) при повышении температуры. Ответ обоснуйте.
67. В каком направлении сместится равновесие СО(г.) + О2(г.) ↔ СО2(г.), ∆Н0= –556 кДж а) при понижении температуры; б) при повышении давления. Ответ обоснуйте.
68. В каком направлении сместится равновесие N2(г.) + О2(г.) ↔ NО(г.), ∆Н0= 180 кДж а) при понижении температуры; б) при повышении давления. Ответ обоснуйте.
69. Вычислите температуру, при которой константа равновесия реакции NО2(г.) ↔ N 2О4(г.) равна единице. В каком направлении сместится равновесие при температуре более низкой, чем полученная.
70. Найдите температуру, при которой константа равновесия реакции НСl(г.) + О2(г.) ↔ Н2О(г.) + Сl2(г.) равна единице.
Дата добавления: 2015-02-16; просмотров: 166 | Поможем написать вашу работу | Нарушение авторских прав |