
Читайте также:
|
Тема 3. ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика – это учение о химическом процессе, его механизме и закономерности протекания во времени. При исследовании химических реакций применяют как методы химической термодинамики, так и методы химической кинетики. Химическая термодинамика позволяет вычислить тепловой эффект данной реакции, а также предсказать, осуществима ли данная реакция и состояние её равновесия, т.е. предел, до которого она может протекать. Но для практики нужно знать не только возможности осуществления данной реакции, но и скорость её протекания. Ответ на этот вопрос даёт химическая кинетика.
Скорость химической реакции – это изменение концентрации одного из реагирующих веществ в единицу времени в единице реакционного пространства.
 ,
,
где С – молярная концентрация одного из реагирующих веществ. Знак «+» относится к изменению концентрации вещества, образующегося в результате реакции, а знак «-», к изменению концентрации вещества, вступающего в реакцию.
Скорость реакции зависит от многих факторов:
1) Природы реагирующих веществ. Так, например, взаимодействие между электролитами, где вещества находятся в ионном виде, протекает практически мгновенно в отличие от взаимодействия молекул с ковалентными связями (органические неполярные растворители);
2) Физического состояния веществ. При изучении скорости химической реакции необходимо различать реакции в гомогенных и гетерогенных системах. Гомогенными называют такие однородные системы, между составными частями которых нет каких-либо поверхностей раздела, например, газовые смеси или растворы.
Гетерогенными называют такие разнородные системы, составные части (фазы) которых отделены друг от друга поверхностями раздела. Сами фазы однородны, т.е. гомогенны. Например, жидкости, сосуществующие с парами или кристаллами, несмешивающиеся жидкости, или же жидкости, сосуществующие одновременно с кристаллами и с газами. Таким образом, системы могут состоять из двух, трех и большего числа фаз и реакция протекает на границе раздела фаз.
Скорость гетерогенных реакций зависит от площади поверхности, на которой они протекают. Увеличение площади поверхности твердого вещества путем измельчения приводит к возрастанию скорости реакции.
.
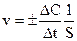 ,
,
где S – площадь границы раздела фаз.
Дата добавления: 2015-02-16; просмотров: 83 | Поможем написать вашу работу | Нарушение авторских прав |