
|
Читайте также: |
Пример 1. Какая масса меди выделяется на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4A, если выход по току равен 100%? Приведите схему электролиза раствора сульфата меди.
Решение. Согласно законам Фарадея
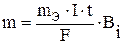 , (1)
, (1)
где m – масса вещества, окисленного или восстановленного на электроде; mэ – эквивалентная масса вещества; I – сила тока, А; t – продолжительность электролиза, с; F – число Фарадея, равное 96500 кл; Вi – выход по току, %.
эквивалентная масса меди в CuSO4 равна:

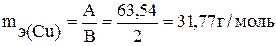 ,
,
где А – атомная масса меди, В – валентность меди.
Подставив в формулу (1) значения mэ=31,77 г/моль, I = 4 А, t = 3600 с, Вi=1, получим
 .
.
схема электролиза раствора сульфата меди:
| Катодный процесс: | К: 
|
| Анодный процесс: | А: 
|
Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 кл электричества и на катоде выделяется 11,742 г металла.
Решение. Изформулы (1) 

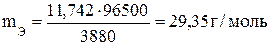 , где
, где
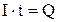 -количество электричества, Кл.
-количество электричества, Кл.
Пример 3. Какие реакции протекают на электродах при электролизе раствора К2SO4, Чемуравна сила тока при электролизе раствора в течении 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода?
Решение. Преобразуем формулу (1) 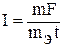 , так как дан объем водорода, то отношение
, так как дан объем водорода, то отношение  заменяем отношением
заменяем отношением 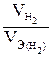 , где
, где 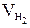 -объем водорода, л;
-объем водорода, л; 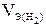 = 11,2 л/моль эквивалентный объем водорода, t = 6025 c (1 ч 40 мин 25 с= 6025 c). Тогда:
= 11,2 л/моль эквивалентный объем водорода, t = 6025 c (1 ч 40 мин 25 с= 6025 c). Тогда:
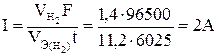
В водном растворе сульфата калия протекают реакции диссоциации по уравнениям: 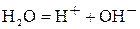 и
и 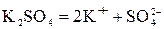
схема электролиза раствора сульфата калия:
| Катодный процесс: | К: 
|
| Анодный процесс: | А: 
|
На аноде выделяется кислород, так как ион 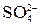 в этих условиях не окисляется. на катоде выделяется водород, так как стандартный потенциал калия (щелочной металл) более отрицателен, чем потенциал водородного электрода (см. в Приложении табл.3 «Стандартные электродные потенциалы (
в этих условиях не окисляется. на катоде выделяется водород, так как стандартный потенциал калия (щелочной металл) более отрицателен, чем потенциал водородного электрода (см. в Приложении табл.3 «Стандартные электродные потенциалы (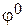 ) некоторых металлов (ряд напряжений)» и в водных растворах разряд этих ионов на катоде не происходит.
) некоторых металлов (ряд напряжений)» и в водных растворах разряд этих ионов на катоде не происходит.
Контрольные вопросы.
117. Определите массу хрома, которая выделится на катоде при электролизе сульфата хрома в течение 3-х часов при токе 13,4 А, если выход хрома по току равен 50%. Приведите схему электролиза раствора сульфата хрома.
118. Какие реакции протекают на электродах при электролизе раствора сульфата цинка: а) с графитовым анодом; б) с цинковым анодом. Как изменится концентрация ионов цинка в растворе в обоих случаях, если через раствор пропустить ток силой 26,8 А в течение 1 часа. Выход по току на катоде цинка 50%, на аноде - 100%.
119. При пропускании тока, силой 2 А в течение 1 часа 14 мин 24 с через водный раствор хлорида металла (II) на одном из графитовых электродов выделился металл массой 2,94 г. Чему равна атомная масса металла, если выход по току 100%, и что это за металл. Напишите уравнения реакций, протекающих на электродах.
120. При пропускании тока, силой 2 А в течение 1 часа 14 мин 24 с через водный раствор хлорида металла (II) на одном из графитовых электродов выделился металл массой 2,94 г. Чему равна атомная масса металла, если выход по току 100%, и что это за металл. Напишите уравнения реакций, протекающих на электродах.
121. При электролизе сульфата натрия получили при н. у. Н2 объемом 448 л. Напишите уравнение реакций, протекающих на нерастворимых аноде и катоде и рассчитайте, сколько времени протекал электролиз, если ток был 100 А.
122. При электролизе раствора сульфата меди на аноде выделился кислород
объемом 560 мл, измеренный при н. у. Сколько граммов меди выделилось на катоде? Приведите схему электролиза.
123. Электролиз раствора сульфата цинка проводили с нерастворимым анодом в течении 6,7 часов, в результате чего выделился кислород объемом 5,6 л, измеренный при н. у. Вычислите ток и массу осажденного цинка при выходе его по току 70%. Приведите схему электролиза.
124. Напишите уравнение реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объеме можно получить при н. у., если пропустить ток 13,4 А в течении 2-х часов.
125. Напишите уравнение реакций, протекающих на графитовых электродах при электролизе: а) расплава MgCl2, б) раствора MgCl2. Сколько времени необходимо вести электролиз при токе 2 А, чтобы на катоде выделилось вещество массой 2,43 г (для реакций а) и б)).
126. Через раствор PbSO4 пропущено 2 F электричества. Как изменится количество Pb2+ в растворе, если электроды: а) графитовые, б) свинцовые. Выход по току свинца составляет на катоде 50%, на аноде - 100%.
127. Найти эквиваленты олова, зная, что при токе, силой 2,5 А из раствора SnCl2 за 30 минут выделяется 2,77 г олова. Написать схему электролиза раствора SnCl2.
128. При электролизе водного раствора Cr2(SO4)3 током, силой 2 А масса катода увеличилась на 8 г. В течении какого времени проводили электролиз? Составьте электронные уравнения процессов, происходящих при электролизе.
129. Сколько времени пропускали ток силой 8 А через раствор сульфата никеля, если масса никелевого анода стала на 0,8805 г меньше? (Написать схему электролиза сульфата никеля).
130. Составьте уравнения реакций происходящих при электролизе: а) раствора NaBr; б) расплава NaBr. Рассчитайте массу веществ, которые выделяются на электродах при прохождении 3,2 А.ч электричества.
131. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора нитрата меди: а) с графитовым анодом, б) с медным анодом. Рассчитайте массу веществ, выделившихся на электродах в случаях а и б при нахождении 6А в течении 2-х часов.
132. При электролизе водного раствора сульфата хрома (III) током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз, если выход по току составляет 50%. Составьте схему электролиза соли.
133. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.) Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
134. В какой последовательности выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cu2+, Ag+, Fe2+. Составьте схему электродных процессов при электролизе водного раствора NiSO4. Сколько граммов никеля выделится на катоде, если на процесс затрачено 13,4 А×ч. Выход по току никеля составляет 80%.
135. Электролиз раствора К2SО4 проводили с нерастворимыми электродами при токе 2,68А в течении 1 часа. Составьте уравнения процессов, происходящих на электродах, вычислите объем выделяющихся при н.у. на электродах веществ.
136. Рассчитайте выход по току кадмия, если при электролизе раствора CdCl2 в течении 1 часа на катоде выделился кадмий массой 5,62 г, а ток был равен 5,36А. Приведите схему электролиза CdCl2.
137. Напишите уравнение реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объеме можно получить при н. у., если пропустить ток 13,4 А в течении 3-х часов.
138. При электролизе раствора CuSO4 на аноде выделилось 334 см3 газа (н.у.) Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
139. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора нитрата свинца: а) с графитовым анодом, б) со свинцовым анодом. Рассчитайте массу веществ, выделившихся на электродах в случаях а и б при нахождении 6А в течении 2-х часов.
140. При электролизе раствора сульфата меди на аноде выделился кислород
объемом 1120 мл, измеренный при н. у. Сколько граммов меди выделилось на катоде? Приведите схему электролиза.
Дата добавления: 2015-02-16; просмотров: 337 | Поможем написать вашу работу | Нарушение авторских прав |