
|
Читайте также: |
Энергия – общая количественная мера движения и взаимодействия всех видов материи.
Теплота – форма беспорядочного движения образующих тело частиц.
Функции состояний – функции независимых параметров системы, изменение к-рых не зависит от пути перехода системы из начального состояния в конечное, а зависят только от состояния системы в этих точках.
Нулевой з-н. т/д. Две системы, находящиеся в т/д-ческом равновесии с третьей, находятся в т/д-ческом равновесии друг с другом.
1 з-н т/д. Кол-во теплоты, сообщенное системе, расходуется на увеличение её внутренней энергии и на совершение работы системой. Q=DU+A Q=DU+pDV.
AT=RTln(p1/p2)
С поглощением тепла эндотермическя реакция –Q, +DH
С выделением тепла экзотермическая +Q, -DH
Тепловой эффект хр – кол-во теплоты, поглощенное или выделенное системой в результате осуществления хим. Процесса при постоянном давлении или объёме или равенстве температур исходных веществ и продуктов и отсутствии всех видов работы, кроме работы расширения.
З-н Гесса. Тепловой эффект хр зависит только от начального и конечного состояния системы и не зависит от пути перехода.
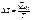 ;
; 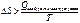
2 з-н т/д. В изолированной системе самопроизвольно протекают только те процессы, к-рые сопровождаются увеличением энтропии.
3 з-н т/д. Энтропия хим. веществ при абсолютном 0 равна 0.
DF=DU-TDS энергия Гельмгольца.
Необратимые реакции:
1) выделение газа Na2CO3+HCl – NaCl+H2O+CO2|
2) выпадение осадка BaCl2+Na2SO4 – BaSO4| +NaCl
3) образование малодиссоциирующих соединений (вода)
4) Выделяется большое кол-во Q H2+Cl2 - 2HCl+Q
DG=-RT ln Kc=DH-TDS Энергия Гиббса.
Уравнение Вант-Гоффа.
Уравнение Аррениуса k=k0*e^(-Ea/RT)
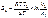
Катализаторы ускоряют только те реакции, в которых энергия Гиббса уменьшилась.
Молярная концентрация – кол-во растворенного вещества в 1л. расвора. Сm
Молярная концентрация эквивалента – число молярных масс эквивалентов растворенного вещества в 1л. раствора. Сэк
Моляльность количество растворенного вещества в 1 кг растворителя
Титр Т - масса (г) растворенного вещества в 1 мл раствора.
Мольная доля X число молей растворенного компонента к общему числу молей раствора.
З-н Рауля. Понижение парциального давления насыщенного пара растворителя над раствором пропорционально мольной доле растворенного вещества. Следствия:
1) повышение температуры кипения раствора пропорционально мольной доле РВ
DTкип=Кэб*Сm
2)температура замерзания раствора ниже температуры замерзания чистого растворителя
DTзамерз=Ккр*Сm
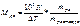
Теория электролитической диссоциации Аррениуса 1887:
1) при растворении в воде электролиты распадаются на положительно и отрицательно заряженные ионы
2) под действием эл. тока катионы движутся к катоду, а анионы к аноду.
3) процесс эл. диссоциации обратимый.
4) альфа, степень элект. Диссоциации, зависит от природы электролита и растворителя, от температуры и концентрации.
По закону Оствальда, 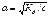
Дата добавления: 2015-02-16; просмотров: 71 | Поможем написать вашу работу | Нарушение авторских прав |