
Читайте также:
|
Стадии:
1) подвод частиц к поверхности, диффузия
2) разрядка частиц, связанная с принятием/отдачей е
3) отвод продуктов реакции
Все эти стадии могут определяться как лимитирующие.
Плотность анодного тока i  А/с функция силы тока
А/с функция силы тока
Применение электролиза:
1) в хим. Пром-ти (производство хлора из НаХл и соды – НаОАш – едкий натр. Хлор для ядов, каучука и т.д.)
2) в металлургии – получение химически чистых свободных металлов – электрометаллургия, Эл-з водных растворов – гидроэлектрометаллургия
Эл-з расплавов и их солей - пироэлектрометаллургия
3)в технике, гальваноплоастика нанесение покрытия металлов, гальваностегия меньшее покрытие, Эл. Хим. Обработка металлов, Эл. Хим. Заточка, шлифование, спец. Обработка поверхностей.
4) сварка, для получения чистых О2 и Аш2
С нерастворимым анодом 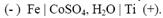

С растворимым анодом 
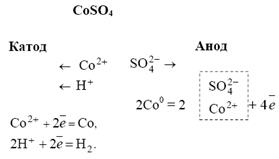
| h=6,626*10-34 Дж/с e=1,6*10-19 Кл m=9,1*10-31 1 Кал=4,184 Дж 1 атм. = 101,3 КПа=101325 Па NA=6,022*1023 | R=8,31 Дж/град*моль K=1,38*10-23 Больцмана |
Электродными или потенциал определяющими процессами называются хим. превращения, происходящие на электродах с участием заряженных частиц, в ходе которых осуществляется перенос частиц через границу раздела двух фаз.
1 з-н Фарадея. Масса итого вещества, претерпевшего электрохим. превращение на каждом из электродов, прямо пропорциональна количеству прошедшего через систему электричества. mi~qi
2 з-н Фарадея. Массы веществ, претерпевших при прохождении через различные системы электрохим. превращения, пропорциональны их массам хим. эквивалентов.
 по закону Фарадея
по закону Фарадея 
Дата добавления: 2015-02-16; просмотров: 108 | Поможем написать вашу работу | Нарушение авторских прав |