
Читайте также:
|
Степень окисления элементов в соединении – заряд иона, вычисленный исходя из предположения, что молекула состоит из ионов. Для соединения с ковалентной связью общая пара как бы полностью переходит к более электроотрицательному элементу, а для простых молекул делится пополам.
Степень окисления соответствует заряду иона или формальному заряду атома в молекуле или в химической формальной единице, например:

Степень окисления указывается сверху над символом элемента. В отличие от указания заряда атома, при указании степени окисления первым ставится знак, а потом численное значение, а не наоборот:
 — степень окисления,
— степень окисления,
 — заряды.
— заряды.
Степень окисления атома в простом веществе равна нулю, например:

Только окислительные свойства проявляет F2, О2 (кроме соединения с F), а также все элементы высшей степени окисления. Только восстановительные св-ва: Ме, а также элементы в минимальной степени окисления. (Н2S-2 – только восст, Н2S+6О3, S0 – окисл (восст), Н2S+6О4 – только окисл)
Есть 2 способа вывода ОВР: метод электронного баланса и ионно-электронный метод (предполагает составление ионных уравнений, процессов восст и окисл с их последующим суммированием в одно уравнение, при этом необходимо соблюдать правила с записью ионных уравнений.
Если среда выводится кислая, то берут серную кислоту, потому что это сильная кислота и в отличие от соляной и азотной, она не участвует в ОВ процессе.
Если среда выводится щелочная то берут КОН или NaОН, т.к. это сильные основания и их соли хорошо растворимы в воде.
7. Комплексные соединения (КС) получаются в результате соединения нескольких сложных молекул в одну. (NH3 + HCl = NH4Cl)
Химик Вернер разработал теорию строения КС.
Координационная теория КС. Согласно ей, в каждом КС различают центральный атом или ион комплексообразователь (КО), вокруг которого располагаются, координируются несколько молекул или ионов противоположного знака – лиганды.
КО с расположенными вокруг него лигандами составляют сверх внутр сферу КС, которую обычно заключают в квадратные скобки.
Число, называющее сколько лиганд координируется вокруг КО, наз координационным числом (КЧ = 2,4,6)
Na[AlCl4]: внеш сфера КС – Na+, внутр сфера КС - [AlCl4]-, КО – Al3+, лиганды – Cl-, КЧ – 4
Диссоциация КС м.б. электролитами и неэлектролитами.
К комплексным электролитам относят КС без внеш сферы ([Pt(NH3)2Br4], [Ni(CO)4])
Комплексные электролиты в водных растворах диссоциируют на комплексный ион и ионы внеш сферы по типу сильных электролитов ([Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl-)
Комплексный ион тоже в свою очередь диссоциирует, однако весьма незначительно на КО и лиганды.
[Ag(NH3)2]+  Ag+ + 2NH3
Ag+ + 2NH3
Kнестойкости = 
Чем меньше коэф нестойкости, тем устойчивей комплексный ион Ку = 1/Кнест
Если коэф нестойкости высокий, то имеем не комплексную, а двойную соль.
NaAl(SO4)2 = Na+ + Al3+ + 2SO42-
Комплексные соли, кислоты и основания, как правило сильные электролиты и более сильные, чем соответствующие им простые.
Cu(OH)2 + 4NH4OH = [Cu(NH4)3](OH)2 + 4H2O
Cu (OH)2 [Cu(NH4)3 ](OH)2
rкатионы →
пд катиона ←
сила основания →
III. Общие св-ва Ме
8. В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью образовывать положительно заряженные ионы. Следовательно, металлы в свободном состоянии являются восстановителями.
А) Взаимодействие Ме с элементарными окислителями
- идеальные условия: Ме – газ, Ок – атомарный
Ме – е = Ме+ - Епар (Еср > Еион)
Ок + е = Ок- + Еср
- реальные условия: Ме – твердый, Ок – молекула
Cl2 = 2Cl - Eдис Cl ≠Сl Еср > Еион + Eдис + L…
Б) Взаимодействие Ме с кислотами
У кислот анионы, которые не проявляют окислительных свойств, окислителем явл протон.
- HCl, H2SO4, H2S, CH3COOH, H2CO3… - H+ - окислитель
Реакция возможна, если Ме в ряду стандартных потенциалов и нах до Н
- H2SO4 к, HNO3
Роль окислителя выполняет анион кислоты.
В) Взаимодействие Ме с водой
Ca0(восст) + Н2+О(окислитель, среда нейтр) → Са+2(ОН)2- + Н2
В реакциях данного типа роль окислителя играют ионы водорода, образующиеся при диссоциации молекул воды. При рН = 7 j°2H+/H2 = -0,41 В, следовательно, с водой теоретически могут реагировать все металлы, имеющие величину j° меньше -0,41 В.
- активные металлы интенсивно взаимодействуют с водой, вытесняя при этом водород:
2K + 2H2O = 2KOH + H2
Аналогичная реакция с Mg протекает при нагревании:
Mg + 2H2O  Mg(OH)2 + H2,
Mg(OH)2 + H2,
исключения составляют: - Be, Al и Sc, поверхность которых покрыта прочными оксидными пленками, нерастворимыми в воде; Mg, образующийся гидроксид которого - Mg(OH)2, малорастворим;
- металлы средней активности при стандартных условиях с водой практически не реагируют, т.к. они или покрыты оксидными пленками, или образуют труднорастворимые гидроксиды (Cr, Ni, Zn) на поверхности металлов.
- малоактивные металлы с водой при обычных условиях не взаимодействуют, поскольку величина их стандартного электродного потенциала значительно больше потенциала окислителя (-0,41 В) и термодинамически данная реакция невозможна.
Г) ОТНОШЕНИЕ МЕТАЛЛОВ К ВОДНЫМ РАСТВОРАМ ЩЕЛОЧЕЙ
С водными растворами щелочей взаимодействуют металлы, расположенные в ряду напряжений до водорода и образующие амфотерные гидроксиды: Be, Al, Zn, Cr, Sn, Pb. Взаимодействие часто обусловлено сдвигом величины электродного потенциала металла в сторону отрицательных значений за счет процесса образования гидроксокомплексов. В качестве примера рассмотрим реакцию:
Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2,
где j ок.(иона H+) = -0,828 В (pH = 14) меньше, чем j восст.(Zn) = -0,763 В. Тем не менее, данный процесс возможен. Его можно представить в виде двух более простых:
1) взаимодействие металла с водой:
Zn + 2H2O = Zn(OH)2 + H2;
2) растворение образующегося амфотерного гидроксида в избытке щелочи с образованием гидроксокомплекса:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
При этом для суммарного процесса величина стандартного электродного потенциала восстановителя равна:
j°[Zn(OH)4]2-/Zn+4OH- = -1,255 В
т.е. jокислителя > jвосстановителя, следовательно, данная реакция возможна.
9. Двойной электрический слой
два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Д. э. с. в целом электронейтрален. При пересечении Д. э. с. электрический потенциал изменяется скачком. Д. э. с. на поверхности металла возникает из-за того, что электроны металла несколько выходят за пределы решётки, образованной положительными ионами. Скачок потенциала в таком Д. э. с. является составной частью работы выхода электрона из металла.
Для электрохимии большое значение имеет Д. э. с. на границе раздела металл — электролит. При погружении металла в раствор, содержащий ионы этого металла, образуется специфический для границы электрод — раствор ионный Д. э. с. дополнительно к Д.э.с., существовавшему на поверхности металла до погружения, и Д. э. с., возникающему в результате ориентации полярных молекул растворителя (например, воды) у поверхности металла. Так, при погружении серебряной пластинки в раствор KNO3 , содержащий очень мало AgNO3, ионы Ag+ переходят из металла в раствор, избыточные электроны в металле заряжают его поверхность отрицательно и притягивают из раствора ионы К+, образующие у поверхности вторую (положительную) обкладку Д. э. с. (см. рис.).

Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Стандартный электродный потенциал – это ЭДС элемента, составленного из норм водородного стандартного электрода и данного Ме, опущенного в раствор своей соли с концентрацией 1моль/л.
Е любого элемента всегда > 0, поэтому знак потенциала определяется знаком, который от имеет в паре с норм водородным электродом.
Значение стандартного потенциала в порядке их возрастания дают ряд стандартных электродных потенциалов Меz+/Ме
Окислительно – восстановительные потенциалы.
Процессы окисл и восст можно пространственно разделить, так, чтобы е передавались от восст к окисл через Ме-проводник. Энергия хим реакции превратится в электрическую. Для этого в растворы, содержащие соответственно окисл и восст опускают инертные электроды (не дают своих ионов – благородные Ме, графит). Замыкая электроды и электролит, получаем ток. Полупроницаемая перегородка пропускает анионы и задерживает катионы.
На платиновых электродах возникает окисл-восст потенциал, величину которого находят:
Уравнение Нернста

z – число электронов, которые переходят от восст к окисл
Сок и Свосс – концентрация окисленной (восстановленной) формы вещ-ва.
 ,
, 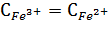
 ;
; 
Элемент работает лишь при условии что его Е > 0, поэтому ОВР в данном направлении возможна лишь при условии, что потенциал окислителя >потенциала восст
Е = φок – φвосст =  -
-  = 0,77 – 0,15 =0,62В
= 0,77 – 0,15 =0,62В
Электродом в электрохимии называют такую систему, в которой токопроводящее вещество помещено в раствор или расплав электролита либо в газ.
Особым видом окислительно-восстановительных электродов являются газовые электрды, в которых одним из активных веществ служит газ. Пример газового электрода - водородный электрод: платина, опущенная в раствор содержащий ионы водорода H + (раствор кислоты), через который пропускается газообразный водород

Рис. 2. Водородный электрод: 1-платина, 2- раствор кислоты
Суммарное равновесие на таком электроде выражается упрощенной схемой:
2Н ++ 2е--->Н2
Рассмотрим более подробно эту схему. Молекулярный водород, проходя через жидкость, растворяется и подходит к поверхности платины (1). На поверхности металла происходят распад молекулы на атомы и их адсорбция (закрепление на поверхности). Адсорбированные атомы водорода Hадс ионизируются:
Hадс-е--- > H+
а ионы водорода, принимая электроны, переходят в адсорбированное состояние:
Таким образом, более полно равновесие в водородном электроде выражается схемой
2Н++ 2е--->Н2
10. Гальванический элемент (Даниэля Якоби). Служит для превращения химической реакции в электрическую.
(-) Zn|ZnSO4||CuSO4|Cu (+)
←SO42-
 ;
; 
(-) На Аноде электроды с меньшим алгебраическим значением Е, всегда идет процесс окисления.
(+) На Катоде электроды с большим алгебраическим значением Е, всегда идет восстановление.
(-) Анод (Zn): Zn – 2e = Zn2+
(+) Катод (Cu): Cu2++ 2e = Cu
Е = φок – φвосст =  -
-  = 0,34 + 0,76 = 1,10В
= 0,34 + 0,76 = 1,10В
Е > 0, он работает
Электролиз
(+) Анод: Сu – 2e = Cu2+
(-) Катод: Zn2++ 2e = Zn
ГЭ Даниэля Якоби – обратимый элемент, т.к. при смене направления тока на электроды идут процессы в обратном направлении.
Обратимые ГЭ представляют интерес в качестве аккумуляторов (хим источники тока).
11. Коррозия Ме – процесс разрушения Ме под воздействием окр.среды.
Хим суть коррозии – окисление Ме.
Ме – zе = Меze
А) Хим коррозия – в газах и неэлектролитов
Б) Электрохим коррозия – при контакте 2-х Ме в среде электролита.
Основной ущерб наносит электрохим коррозия. Любой технический Ме содержит примеси др. Ме, и поэтому в среде электролита возникает большое кол-во микрогальванических элементов.
Их работу можно объяснить пользуясь значениями стандартных потенциалов.
Коррозия подвергает хим более активные Ме, т.е. тот Ме, Е которого меньше по алгебраическому значению.
| Fe – 2e |
| HCl |
 ;
; 
(-) Анод (Fe): Fe – 2e = Fe2+
(+) Катод (Cu): 2Н+ + 2е = Н2
[H+]↓, [Fe2+]↑ φок↓ φвосст↑
Е = φок – φвосст↓ - Поляризация – Е < 0
Обратное явл наз Деполяризацией
Частицы среды разряжающиеся на катоде наз деполяризаторами (H+)
Деполяризаторами м.б. разные окислители, но на практике чаще встречаются с кислородной и водородной деполяризацией, т.к. это самые доступные в природе окислители, т.к. О2 содержится в воздухе, а Н+ в Н2О и её растворах.
Если О2 присутствует, то коррозия всегда идет с кислородной деполяризацией, т.к. независимо от характера среды, кислород более сильный окислитель, чем водород (по табл).
В зависимости от характера среды и природы деполяризатора на катоде, т.е менее активные Ме, идут след реакции:
- коррозия с водородной деполяризацией
рН < 7 (кисл среда): 2Н+ + 2e = H2
pH ≥ 7 (нейтр/щел среда): 2Н2О + 2е = Н2 +2ОН-
- коррозия с кислородной деполяризацией
рН < 7: О2 + 4e + 4H+ = 2H2O
pH ≥ 7: О2 + 4е + 2H2O = 4ОН-
Защита Ме от коррозии: Защитные покрытия неМе (краски, лаки, резина, пластмасса), Ме (анодные)
12. Электро́лиз — окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз - это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливчаются друг от друга. Отличие - в наличии растворителя. При электрролизе растворов кроме ионов самого вещества в процессе учавствуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
1 закон Фарадея
Масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:

если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности  называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.

2 закон Фарадея записывается в следующем виде:

где  — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;  — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с; 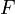 — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1;  — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного).
13. В химическом отношении железо, кобальт и никель относятся к металлам средней активности. В электрохимическом ряду напряжений металлов они располагаются левее водорода, между цинком и оловом. Чистые металлы при комнатной температуре довольно устойчивы, их активность сильно увеличивается при нагревании, особенно если они находятся в мелкодисперсном состоянии. Наличие примесей значительно снижает устойчивость металлов.
Взаимодействие с неметаллами
При нагревании на воздухе выше 200 °С железо взаимодействует с кислородом, образуя оксиды нестехиометрического состава FexO, мелкодисперсное железо сгорает с образованием смешанного оксида железа (II, III):
3Fe + 2O2 = Fe3O4.
Кобальт и никель реагируют с кислородом при более высоких температурах, образуя в основном оксиды двухвалентных элементов, имеющие переменный состав в зависимости от условий получения:
2Co + O2 = 2CoO,
2Ni + O2 = 2NiO.
С галогенами металлы реагируют, образуя галогениды:
2Fe + 3Cl2 = 2FeCl3,
Co + Br2 = CoBr2,
Ni + Cl2 = NiCl2.
Металлы довольно устойчивы к действию фтора, никель не разрушается фтором даже при температуре красного каления.
При взаимодействии с азотом при невысокой температуре железо, кобальт и никель образуют нитриды различного состава, например:
4Fe + N2 = 2Fe2N,
2Co + N2 = 2CoN,
3Ni + N2 = Ni3N2.
Взаимодействие с серой экзотермично и начинается при слабом нагревании, в результате образуются нестехиометрические соединения, которые имеют состав, близкий к ЭS:
Э + S = ЭS.
С водородом металлы триады железа не образуют стехиометрических соединений, но они поглощают водород в значительных количествах.
С углеродом, бором, кремнием, фосфором также при нагревании образуют соединения нестехиометрического состава, например:
3Co + C = Co3C,
2Ni + B = Ni2B,
Co + Si = CoSi,
3Fe + P = Fe3P.
Дата добавления: 2015-02-16; просмотров: 113 | Поможем написать вашу работу | Нарушение авторских прав |
|
| <== предыдущая лекция | | | следующая лекция ==> |
| Сигналы, подаваемые сигнальщиком командиру ВС | | | Понятие гражданского права как отрасли права. |