
|
Читайте также: |
Обычно растворённый в воде кислород непосредственно не определяют, а о его концентрации судят по количеству выделяющегося йода в результате следующих операций. В склянку с пробой воды вводят раствор соли двухвалентного марганца и щелочную смесь (KI + KOH). Вначале хлорид марганца реагирует с КОН, образуя Мn(ОН)2:
МnС12 + 2КОН → Мn(ОН)2↓ + 2КС1.
Полученный Мn(ОН)2 представляет собой осадок белого цвета, это соединение неустойчивое, легко окисляется растворенным в воде кислородом до Мn(ОН)4 бурого цвета:
2Мn(ОН) 2 + O2 + 2Н2О → 2Мn(ОН)4↓.
По окончании реакции окисления в склянку приливают концентрированную соляную кислоту. При этом Mn4+ вновь восстанавливается до Mn2+:
Мn(ОН)4 + 4HC1→ МnС12 + С12 + 4Н2O.
Выделяющийся хлор, количество которого эквивалентно содержанию растворенного кислорода, взаимодействует с йодидом калия, образуя свободный йод. Выделившийся йод оттитровывают тиосульфатом натрия:
Cl2 + 2KI → I2 + 2KCl,
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI.
Оборудование и реактивы: коническая колба объёмом 250 мл; мерные цилиндры объёмом 10 и 100 мл; раствор Na2S2O3 0,01 н; щелочная смесь КОН + KI; МnС12·4Н2O (45%-ный раствор); крахмал (1%-ный раствор); НСl (плотностью 1,19 г/мл); мерные пипетки объёмом 1 мл; бюретка объёмом 25 мл.
Ход работы:
Щелочную смесь готовят из 70 гКОН и 15 г КI, которые сначала растворяют в небольшом количестве дистиллированной воды, а затем объём доводят до 1 л. В мерную колбу объёмом 250 млотмеряют 100 мл исследуемой воды. Опуская пипетку до дна склянки, приливают по 1 млраствора МnС12 и раствора щелочной смеси (KOH + KI). Закрывают склянку пробкой, взбалтывают и оставляют на 5 минут для отстаивания образовавшегося осадка. Бурый осадок Мn(ОН)4 растворяют при перемешивании, прибавляя 2 – 3 млконцентрированной соляной кислоты. Оттитровывают выделившийся йод 0,01 н. раствором тиосульфата натрия в присутствии 1 млраствора крахмала до исчезновения синей окраски. Количество растворённого в воде кислорода вычисляют по формуле:
 ,
,
где Х – содержание растворённого кислорода, мг/л; V – объём раствора Na2S2O3, пошедший на титрование пробы воды, мл; Сн– нормальная концентрация раствора Na2S2O3, моль/л; Мэ – молярная масса эквивалента кислорода (8,00 г/моль); 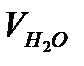 – объём исследуемой воды, мл; Vреак. – объём добавленных реактивов, мл.
– объём исследуемой воды, мл; Vреак. – объём добавленных реактивов, мл.
Дата добавления: 2015-09-11; просмотров: 76 | Поможем написать вашу работу | Нарушение авторских прав |