
Читайте также:
|
Візьмемо речовину у вигляді рідини і яка знаходиться у рівновазі насиченої пари і, не змінюючи об’єму, віднімати від неї тепло. Цей процес буде супроводжуватися зниженням температури речовини і відповідно зменшенням тиску. Тому точка, яка зображує стан речовини на діаграмі (p,T), переміщується вниз по кривій випаровування. Це продовжується до тих пір, поки не досягнеться температура кристалізації речовини, яка відповідає рівноважному значенню тиску. Позначимо цю температуру Тmр. Весь час, поки йде процес кристалізації, температура і тиск залишаються незмінними. Тепло, що відводиться при цьому, представляє собою тепло, що виділяються при кристалізації.
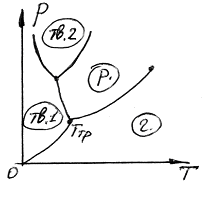
Температура Тmр і відповідний їй рівноважний тиск pmp - єдині значення температури і тиску, при яких можуть знаходитись в рівновазі три фази рідини: тверда, рідка і газоподібна. Відповідна точка на діаграмі (p,T) називається потрійною точкою. Таким чином, потрійна точка визначає умови, за яких можуть знаходитись в рівновазі одночасно три фази речовини.

По закінченню процесу кристалізації, в рівновазі будуть тверда і газоподібна фази. Якщо продовжувати забирати тепло від речовини, то температура знову почне знижуватись. Відповідно зменшиться тиск пари, що знаходиться в рівновазі з кристалічною фазою. Точка, що зображує стан речовини, переміщується вниз по кривій сублімації.
Температура потрійної точки є температура, при якій плавиться речовина, знаходячись під писком, що дорівнює pmp. При інших тисках температура плавлення буде іншою. Зв’язок між тиском і температурою плавлення зобразиться кривою плавлення, що починається в потрійній точці.
Криві плавлення, випаровування і сублімації розбивають координатну площину на три області. Зліва від кривих плавлення і сублімації – область твердої фази, між кривими плавлення і випаровування – область рідких станів, справа від кривих сублімації і випаровування – область газоподібних станів речовини.
Будь-яка точка в одній з цих областей зображує відповідний однофазний стан речовини (рівноважний). Будь-яка точка, що лежить на одній з кривих, зображує стан рівноваги двох відповідних фаз речовини. Потрійна точка зображує рівновагу всіх трьох фаз. Таким чином, кожна точка на діаграмі зображує певний стан речовини, тому її називають діаграмою стану.
Якщо речовина має кілька кристалічних модифікацій, діаграма стану має складніший характер.
Дата добавления: 2015-09-11; просмотров: 70 | Поможем написать вашу работу | Нарушение авторских прав |