
|
Читайте также: |
1. Пользуясь термодинамическим данными, приведенными в табл. П.1, рассчитать константы равновесия Kр 1(Т к) и Kр 2(Т к) по формулам (П.14), (П.16) и (П.18) первого, второго и третьего приближений в интервале температур Т к = 1000 – 1500 K.
2. Используя результаты п. 1, рассчитать по формулам (П.6) и построить температурные зависимости р СО(Т к),  и р СО /
и р СО /  = f (Т к) для трех приближений.
= f (Т к) для трех приближений.
3. Пользуясь термодинамическим данными, приведенными в табл. П.2, для выбранной пары металл - окисел рассчитать Kр 3(Т) по формулам (П.14), (П.16) и (П.18) первого, второго и третьего приближений в интервале температур Т = 500 – 1500 K.
4. Используя результаты пп. 2 и 3, построить на одном графике температурные зависимости р СО /  = f (Т к) и Kр 3(Т) для трех приближений и по знаку
= f (Т к) и Kр 3(Т) для трех приближений и по знаку 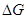 в формуле (П.20) сделать вывод о возможного окисления выбранного металла.
в формуле (П.20) сделать вывод о возможного окисления выбранного металла.
П.2. Химическое осаждение арсенида галлия из газовой фазы в системе GaAs – H2O – H2
Общие сведения. Газотранспортные химические реакции широко применяются в современной полупроводниковой технологии для эпитаксиального выращивания монокристаллических слоев с высокой степенью структурного и электрофизического совершенства. Для этой цели в газовый поток, создаваемый газом-носителем (каковым чаще является водород), вводится так называемый транспортный агент. Его основная функция – осуществлять травление полупроводникового материала с образованием газообразных продуктов реакции, переносимых потоком (конвекционным или диффузионным) из зоны травления в зону осаждения (см. п. 3.5).
Для арсенида галлия роль транспортного агента могут выполнять пары воды H2O. Основной газотранспортной реакцией при этом является реакция с образованием летучего окисла Ga2O:
2GaAs(т) + H2O(г) 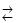 Ga2O(г) + As2(г) + H2(г),
Ga2O(г) + As2(г) + H2(г), 
 . (П.21)
. (П.21)
В изучаемой системе наряду с основной газотранспортной реакцией (П.21) возможно протекание конкурирующих реакций, препятствующих транспорту арсенида галлия в газовой фазе с помощью паров воды. Это происходит вследствие связывания галлия в форме новой конденсированной фазы. Такими фазами являются твердый окисел Ga2O3(т) и жидкий галлий Ga(ж), образующиеся по реакциям
 GaAs(т) + H2O(г)
GaAs(т) + H2O(г) 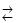
 Ga2O3(т) +
Ga2O3(т) +  As2(г) + H2(г),
As2(г) + H2(г), 
 , (П.22)
, (П.22)
2GaAs(т) 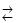 2Ga(ж) + As2(г),
2Ga(ж) + As2(г), 
 . (П.23)
. (П.23)
Возможность осуществления кристаллизации GaAs в соответствии с газотранспортной реакцией (П.21) при условии подавления конкурирующих реакций (П.22) и (П.23) оценивают по составу газовой фазы. Парциальные давления газообразных компонентов 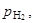

 и
и  формируемые реакцией (П.21), рассматриваются как неравновесные для конкурирующих реакций. Эти давления навязываются реакциям (П.22) и (П.23) основной реакцией (П.21) и в общем случае отличаются от давлений
формируемые реакцией (П.21), рассматриваются как неравновесные для конкурирующих реакций. Эти давления навязываются реакциям (П.22) и (П.23) основной реакцией (П.21) и в общем случае отличаются от давлений 
 и
и  равновесных для этих реакций. Подавление конкурирующих реакций имеет место при условии, если их изобарный потенциал, вычисленный по уравнению изотермы Вант-Гоффа (3.23), положителен (D G > 0). В этом случае реакции (П.22) и (П.23) смещены влево, так что образования твердого окисла Ga2O3(т) и жидкого галлия Ga(ж) не происходит.
равновесных для этих реакций. Подавление конкурирующих реакций имеет место при условии, если их изобарный потенциал, вычисленный по уравнению изотермы Вант-Гоффа (3.23), положителен (D G > 0). В этом случае реакции (П.22) и (П.23) смещены влево, так что образования твердого окисла Ga2O3(т) и жидкого галлия Ga(ж) не происходит.
Очевидно, что первым этапом анализа является определение температурного хода констант равновесия для реакций (П.21) - (П.23) на основании таблиц стандартных термодинамических величин.
Расчёт констант химического равновесия. Нередко в справочниках приведены термодинамические величины, связанные с абсолютными значениями термодинамических функций  и
и  , полученными на основе спектроскопических данных. В частности, дается температурная зависимость для функции
, полученными на основе спектроскопических данных. В частности, дается температурная зависимость для функции
 ,
,
значения которой приведены в табл. П.5.
Таблица П.5
  Функция Функция
| T, K | Вещество (состояние) | |||||||
| H2 (г) | H2O (г) | As2 (г) | As4 (г) | Ga2O (г) | Ga2O3 (т) | Ga (ж) | GaAs (т) | ||
 Ф Т Ф Т

| 33,153 | 47,406 | 59,60 | 80,34 | 73,03 | 25,63 | 19,90 | 16,27 | |
| 33,715 | 48,089 | 60,29 | 81,88 | 74,07 | 27,38 | 20,79 | 16,76 | ||
| 34,25 | 48,749 | 60,95 | 83,34 | 75,08 | 29,07 | 21,57 | 17,20 | ||
| 34,76 | 49,382 | 61,58 | 84,76 | 76,04 | 30,71 | 22,27 | 17,65 | ||
| 35,24 | 49,991 | 62,17 | 86,11 | 76,96 | 32,30 | 22,90 | 18,10 | ||
| 35,69 | 50,575 | 62,74 | 87,35 | 77,83 | 33,82 | 23,48 | 18,43 | ||
| 36,13 | 51,136 | 63,28 | 88,56 | 78,66 | 35,24 | 24,01 | 18,88 | ||
 
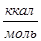
| -57,8 | 48,0 | 34,5 | -19,7 | -240 | 1,335 | -17,7 |
Нетрудно видеть что, в этом случае стандартный изобарный потенциал реакции  вместо выражения (П.8) записывается как
вместо выражения (П.8) записывается как
 . (П.24)
. (П.24)
Константа химического равновесия Kp (Т) связана с величиной  тем же соотношением (П.7), тогда с учетом (П.24) получаем
тем же соотношением (П.7), тогда с учетом (П.24) получаем
 . (П.25)
. (П.25)
Стандартная теплота реакции  вычисляется, как и ранее, по формуле (П.10), а величина D Ф Т – по общему правилу:
вычисляется, как и ранее, по формуле (П.10), а величина D Ф Т – по общему правилу:
 , (П.26)
, (П.26)
при этом значения Ф Т (Ак) и Ф Т (Ан) берутся из табл. П.5 для конечных Ак и начальных Ан участников рассматриваемой реакции.
Расчёт состава газовой фазы. Обычно процесс транспорта арсенида галлия парами воды проводится в открытой проточной системе под давлении 1 атм. Однако, для общности будем принимать суммарное давление равным Р, тогда
Р =  +
+  +
+  +
+  . (П.27)
. (П.27)
На вход системы подаётся в качестве газа-носителя водород под давлением  насыщенный парами воды с парциальным давлением
насыщенный парами воды с парциальным давлением  путём пропускания через специальный сосуд с водой, называемый барботером. Величина
путём пропускания через специальный сосуд с водой, называемый барботером. Величина  регулируется при помощи температуры барботера и измеряется точкой росы увлажненного водорода. Относительная влажность водорода задаётся параметром
регулируется при помощи температуры барботера и измеряется точкой росы увлажненного водорода. Относительная влажность водорода задаётся параметром
 , (П.28)
, (П.28)
где 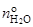 и
и  - число молей паров воды и водорода, вводимых в систему.
- число молей паров воды и водорода, вводимых в систему.
Пусть по реакции (П.21) вступило во взаимодействие с арсенидом галлия  молей паров воды, где a - степень превращения. Тогда в соответствии со стехиометрией реакции равновесное число молей в системе с учетом (П.28) таково:
молей паров воды, где a - степень превращения. Тогда в соответствии со стехиометрией реакции равновесное число молей в системе с учетом (П.28) таково:
 ,
,
 , (П.29)
, (П.29)
.  .
.
Полное число газовых молей по аналогии с (П.27) записывается как
 . (П.30)
. (П.30)
Отсюда парциальное давление каждого компонента, рассчитанное с использованием (П.29) и (П.30) по формуле pi = (ni / n) p, равняется
 , (П.31)
, (П.31)
 , (П.32)
, (П.32)
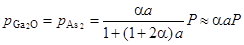 , (П.33)
, (П.33)
где приближённые равенства получены с учётом малости величены a = 10 -2 ¸ 10 -4.
Подставляя выражения (П.31) – (П.33) в закон действия масс для реакции (П.21), получаем уравнение для нахождения степени превращения a как функции трёх управляемых параметров технологического процесса P, T, и а:
 . (П.34)
. (П.34)
Решение уравнения (П.34) имеет вид
 . (П.35)
. (П.35)
Найденная функциональная зависимость a = f (T, a) при Р = const позволяет рассчитать по формулам (П.32) и (П.33) парциальные давления 
 и
и 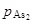 как функции температуры Т и относительной влажности водорода а.
как функции температуры Т и относительной влажности водорода а.
Область стехиометричности газовой фазы. Для термодинамической оценки возможности подавления конкурирующих реакций необходимо рассчитать их изобарный потенциал D G для давлений в системе, полученных из расчёта состава газовой фазы, созданного основной реакцией (П.21). Такую газовую фазу принято называть стехиометрической. Уравнение изотермы Вант-Гоффа (3.23) для конкурирующих реакций имеет следующий вид:
а) для реакции (П.22)
 , (П.36)
, (П.36)
б) для реакции (П.23)
 . (П.37)
. (П.37)
Эти выражения содержат парциальные давления компонентов стехиометрической газовой смеси 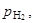
 и
и  ранее полученные в виде (П.31) – (П.33).
ранее полученные в виде (П.31) – (П.33).
 Решение уравнений
Решение уравнений 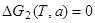 и
и 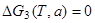 , описывающих равновесие реакций (П.22) и (П.23), дает на плоскости T - a, показанной на рис. П.1, две линии 2 и 3, ограничивающие область 1, где протекает основная реакция (П.21) и подавлены конкурирующие реакции (П.22) и (П.23). За пределами этой области, наряду с основной реакцией (П.21), протекает ниже линии 2 реакция (П.22) с образованием нелетучего окисла Ga2O3(т), а выше линии 3 - реакция диссоциации арсенида галлия (П.23) с образованием жидкого галлия Ga(ж). Одновременное подавление обеих конкурирующих реакций, гарантированное неравенствами
, описывающих равновесие реакций (П.22) и (П.23), дает на плоскости T - a, показанной на рис. П.1, две линии 2 и 3, ограничивающие область 1, где протекает основная реакция (П.21) и подавлены конкурирующие реакции (П.22) и (П.23). За пределами этой области, наряду с основной реакцией (П.21), протекает ниже линии 2 реакция (П.22) с образованием нелетучего окисла Ga2O3(т), а выше линии 3 - реакция диссоциации арсенида галлия (П.23) с образованием жидкого галлия Ga(ж). Одновременное подавление обеих конкурирующих реакций, гарантированное неравенствами  > 0 и
> 0 и  > 0, возможно лишь для области 1, лежащей левее точки пересечения А кривых 2 и 3 на рис. П.1. Именно эта область называется областью стехиометричности газовой фазы, так как для нее соотношение между парциальными давлениями газообразных компонентов удовлетворяет стехиометрии основной газотранспортной реакции (П.21). Внутренние точки этой области соответствуют оптимальным режимам проведения эпитаксиального процесса выращивания арсенида галлия в системе GaAs – H2O – H2.
> 0, возможно лишь для области 1, лежащей левее точки пересечения А кривых 2 и 3 на рис. П.1. Именно эта область называется областью стехиометричности газовой фазы, так как для нее соотношение между парциальными давлениями газообразных компонентов удовлетворяет стехиометрии основной газотранспортной реакции (П.21). Внутренние точки этой области соответствуют оптимальным режимам проведения эпитаксиального процесса выращивания арсенида галлия в системе GaAs – H2O – H2.
Дата добавления: 2015-09-10; просмотров: 104 | Поможем написать вашу работу | Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| П.1. Состав газовой фазы и окисляемость металлов при термообработке оксидного катода | | | Задание 2 |