
Читайте также:
|
Термодинамические расчеты оказываются наиболее простыми, если каждый компонент смеси в целом подчиняется законам идеальных газов.
Теплоты реакции ∆U (при Ѵ=const) и ∆H (при р=const) не зависят от объема или давления системы, но зависят от температуры. Если u₀ и u – реакционные объемы, а, р₀, р – давление в системе, то ∆U_ = ∆U_, ∆Нр₀ = Нр при u_≠ u и p_ ≠ p.
Для реакций: ∆Нт = ∆Нт0 +  (40)
(40)
Поскольку ∆Нт = ∆Uт + р∆u, а для превращения стехиометрических количеств реагентов: р∆u = (∑ Ѵ1)RT, то
∆Нт = ∆Uт + (∑Ѵ1)RT,(41)
где ∑ Ѵ – изменении числа молей при реакции.
Итак, можно использовать табличные данные для расчета ∆Ни затем, если нужно, из последнего уравнения найти ∆U.
Величины ∆S и ∆G зависят от давления. В соответствии с соотношениями термодинамики при Т=const:
 T = −
T = −  ,
, 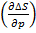 T= −
T= −  = −(∑Ѵ1)
= −(∑Ѵ1)  , (42)
, (42)
т.е. при проведении реакции при давлениях р и р₀:
∆Sp= ∆Sp0 −  = ∆Sp0 − (∑Ѵ1)Rln
= ∆Sp0 − (∑Ѵ1)Rln  , (43)
, (43)
Кроме того
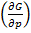 T = u,
T = u,  T = ∆u = (∑Ѵ1)
T = ∆u = (∑Ѵ1)  , (44)
, (44)
Поэтому
∆Gp= ∆Gp₀ + 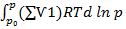 = ∆Gp₀+ (∑Ѵ1)RTdln
= ∆Gp₀+ (∑Ѵ1)RTdln  (45)
(45)
Если используют стандартные термодинамические таблицы, то, выполнив расчет для стандартного давления р⁰(р₀=р⁰), можно пересчитать ∆Sp и ∆Gp для любо иного давления по приведенным соотношения.
Расчет на основе данных стандартных термодинамических таблиц позволяет определить величину ∆G⁰. Она не зависит от р. По этой величине легко рассчитать
Кр⁰= exp(−∆G⁰/ RT), Kp = Kp⁰ (p⁰)∑v₁, или Kc= Kp (RT)-∑v₁, или KN = Kpp-∑v₁
Дата добавления: 2015-02-22; просмотров: 65 | Поможем написать вашу работу | Нарушение авторских прав |