
Читайте также:
|
Задача. 1 Подсчитать тепловой эффект процесса гидрокрекинга вакуумного газойля (350-460 ⁰С, d₄²⁰ = 0,934), если известно, что выходы продуктов (в % масс.) следующие: сухой газ 3,1; бутановая фракция 3,2; фракция 40-82 ⁰С 5,4; фракция 82-149 ⁰С 9,7; фракция 149-288 ⁰С 78,6.
Принимают молекулярную массу газа М₁ = 30.
Ответ: ― 340,7 кДж/кг сырья
Задача. 2 Определить тепловой эффект процесса каталитического крекинга тяжелого газойля (350-500 ⁰С), если молекулярная масса продуктов крекинга 145.
Ответ: +376 кДж/кг сырья.
2 Практическое решение задач кинетического анализа процессов химической технологии топлива и углеродных материалов
Химическая термодинамика дает информацию о состоянии системы только в условиях равновесия. Для решения многих задач химической науки и технологии необходимо знать закономерности, определяющие протекание процесса в пространстве и времени. Они выявляются при его экспериментальном исследовании. Одной из главных задач экспериментального исследования химического процесса с целью количественного анализа является определение кинетических величин: скорости реакции, предэкспоненциального множителя, энергии активации, порядка рекции, вида кинетического уравнения, Кинетический метод исследования имеет строгое научное обоснование и является универсальным для количественного изучения разнообразных процессов. Он имеет важное значение в двух аспектах: теоретическом (для обоснования реакций и решения ряда вопросов реакционной способности) и практическом (для расчета химических реакторов, для моделирования и оптимизации протекающих в них процессов). Кинетические характеристики реакций, характеризующие процессы переработки нефти, угля, природного газа, промышленного органического синтеза приведены в [10,11].
2.1 Определение кинетических характеристик химических процессов переработки топлива и получения углеродных материалов
Кинетика простых реакций: k
Необратимая реакция первого порядка – реакция типа A→B
Мгновенная скорость такой реакции w пропорциональна концентрации вещества А и обозначается СА:
w = ―  = kCA, (81)
= kCA, (81)
где k – константа скорости реакции.
К моменту времени t от начала реакции концентрации вещества А можно определить по управлению:
СА =  (82)
(82)
где СА – начальная концентрация вещества А при t = 0
Время, за которое исходная концентрация СА⁰ уменьшается в 2 раза, называется временем полупревращения и обозначается  .
.
Для реакции первого порядка:
 =
=  , (83)
, (83)
Среднее время жизни молекулы:t =  (84)
(84)
Необратимые реакции второго порядка – реакции типа
kk
а) А + А → Р или б) А + В → Р
Мгновенные скорости реакций определяются по уравнениям:
а) w = ―  = kC²A;б) w = ―
= kC²A;б) w = ―  = ―
= ―  = kCACB (85)
= kCACB (85)
Концентрации реагирующих веществ к моменту времени определяются по уравнениям:
а)  −
−  = kt, б)ln
= kt, б)ln  = kt (86)
= kt (86)
Необратимые реакции n-го порядка – реакции типа aA + bB + cC + …
→ продукты реакции, где (a + b + c … = n).
Наибольший интерес представляет случай взаимодействия одинаковых молекул: nA → продукты реакции.
Для этого случая кинетические уравнения таковы:
w = −  = k
= k 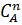 ;
;  −
−  =(n-1)kt (87)
=(n-1)kt (87)
где  - конечная концентрация веществе А
- конечная концентрация веществе А
Дата добавления: 2015-02-22; просмотров: 148 | Поможем написать вашу работу | Нарушение авторских прав |